Die pigmentierte villonduläre Synovialitis – kurz die PVNS – ist ein seltener, gutartiger aber biologisch aktiver und proliferativer Tumor. Er ist lokal oft aggressiv und findet sich zumeist in oder an den großen Gelenken, im Schleimbeutel oder an den Sehnenscheiden.
Synonym werden u.a. die Begriffe des tenosynovialen Riesenzelltumors und des Riesenzelltumors der Sehnenscheide benutzt. Im Englischen, in internationalen Bibliotheken wird in der Literaturrecherche der Begriff TGCT (tenosynvial giant cell tumor) die Suche erleichtern. Unter all diesen Begriffen findet sich dieselbe Erkrankung, deren Ursache nicht bekannt ist und die nach wie vor teils erhebliche Schwierigkeiten in der Therapie darstellen kann. Laut der WHO Klassifikation von Tumoren (5. Ausgabe; 2020) wird diese Entität in einer Gruppe von typischen gutartigen Läsionen gesehen, welche die gleiche Pathogenese und das gleiche histologische Erscheinungsbild darstellen.1
Während medizinisch gesehen die noduläre oder monolokuläre Form der PVNS für Patient und Operateur eher wenig aufregend ist, kann die diffuse und nicht selten aggressive Form der PVNS schon einen beträchtlichen Schaden in Form von Gelenkdestruktionen anrichten. Zudem kann sie häufig rezidivieren und insbesondere über ihren inflammatorischen Charakter eine klinisch erhebliche Schmerzsymptomatik bei den betroffenen Patienten hervorrufen. Die diffuse Form kommt darüber hinaus nicht selten nicht nur innerhalb, sondern auch außerhalb des betroffenen Gelenks vor.
Über die Inzidenz finden sich in der Literatur unterschiedliche Angaben, über ein Vorkommen von 2–8 Erkrankungen/1 Mill. wird berichtet; das dänische Register beschreibt in einer registerbasierten Cohorten-Studie eine Prävalenz von 44 pro 100.000 für die monolokuläre und von 12 pro 100.000 für die diffuse Form, resp. eine Inzidenzrate pro 1. Mio pro Personen-Jahre von 30.3 für den lokalisierten Typ und von 8.4 für den diffusen Typ.2 Eine höhere Dunkelziffer, die von anderen Autoren für die problemlosere noduläre Form für wahrscheinlich erachtet wird, erscheint auch uns vorstellbar, da vermutlich nicht jede dieser Erkrankungen gemeldet wird.
Patienten sind in der Regel im mittleren Lebensalter mit einem Peak zwischen dem 40. Und 59. Lebensjahr;3 aber auch Kinder, sogar Säuglinge4 können betroffen sein. Eine sichere GenderDominanz zeigt sich nicht, die Angaben in den verschiedenen Registern schwanken, zeigen aber möglicherweise eine leichte Dominanz der Frauen sowohl in der nodulären Form (ca. 60 %) wie auch in der diffusen Form (50–60 %).
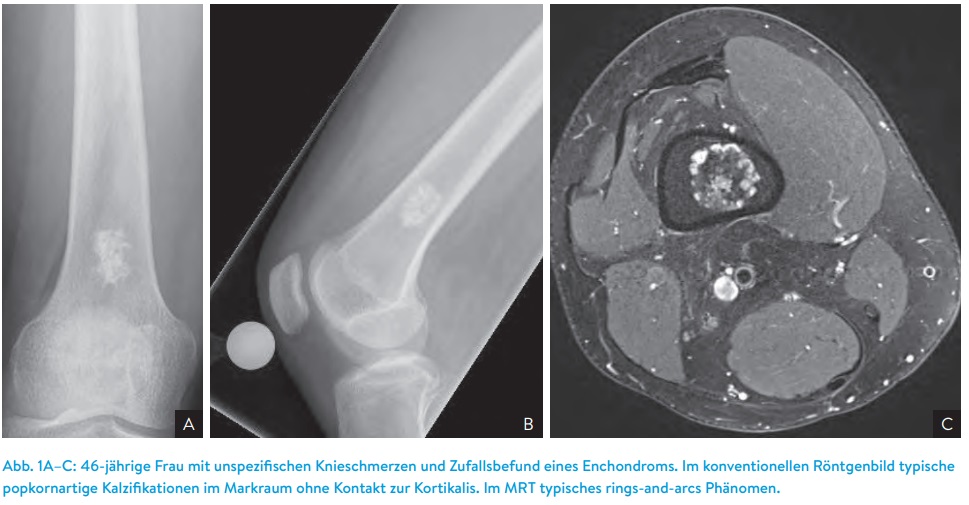
Üblicherweise ist im muskuloskelettalen System immer nur eine Lokalisation – ein Gelenk bzw. eine Region – betroffen, multiartikläre Formen sind eine Seltenheit. Im Bereich der Finger oder der Zehen finden sich die Tumorformationen oft an der Beugeseite, können sich aber auch circumferent ausbreiten. Das Gelenk, was mit Abstand am häufigsten betroffen ist, ist das Kniegelenk, hier kommen sowohl die diffuse Form wie auch die noduläre Form vor, gefolgt von Sprunggelenk, Hüftgelenk und seltener Schultergelenk, bei letzterem vornehmlich die diffuse Form. Sehr selten, aber in der Literatur auch beschrieben, sind das Vorkommen der PVNS im Bereich der Kiefergelenke oder aber sogar der Facettengelenke der Wirbelsäule. Grundsätzlich scheint somit kein Gelenk für das Auftreten dieser Neoplasie ausgeklammert zu sein (Abbildung 1).
Über die Ätiologie der PVNS ist wenig bekannt. Klar ist, dass es sich nicht um eine primär entzündliche Erkrankung der Schleimhaut handelt. Die Ansicht, dass möglicherweise ein Trauma eine kausale Ursache hat, lässt sich sicher nicht halten, auch wenn einige Autoren eine bis zu 5 % vorkommende Anamnese eines Weichgewebstraumas zum Zeitpunkt der initialen Präsentation des Tumors angeben.
Die Entstehung des tenosynovialen Riesenzelltumors ist assoziiert mit einem clonalen neoplastischen Prozess, der oft chromosomale Abberationen mit einer Translokation t(1;2) (CSF-1;COL6A3) aufweist, die zu einer Überexpression von colony-stimulierenden Faktor1 (CSF1) und zu einer Aktivierung von Makrophagen, Riesenzellen und Osteoklasten führen. Histologisch imponiert das Bild einer Proliferation von Synovialzellen, auch wenn nur ein geringer Anteil der Zellen tatsächlich die chromosomale Abberation aufweist (etwa 2–16 %);5 die restlichen Zellen sind nicht-neoplastische reaktive Zellen. Durch die Überexpression von CSF1 werden durch die Tumorzellen eine inflammatorische Infiltration von mononukleären und von multinukleären Riesenzellen induziert, die dann das Bild der Osteoklasie, sprich des Knochenabbaus und damit der Osteolysen in dem gelenkbildenen Knochen zeigen können. Dies erklärt dann natürlich, warum bereits in der nativen Röntgenaufnahme der Gelenk-Knochen Osteolysen aufweist und das Gelenk starke Destruktionen aufweisen kann.
Gleichzeitig werden Zytokine bzw. Botenstoffe freigesetzt, die nicht nur zu Entzündungen führen, sondern über Tumornekrosefaktor alpha werden Proteinasen (MMP) produziert, die dann neben dem Knochen auch den Knorpel zerstören.
Klink
Der tenosynoviale Riesenzelltumor der Sehnenscheide, der ja die häufigste Form ist, tritt in der orthopädischen Praxis deswegen weniger in Erscheinung, weil er oft klinisch relativ stumm ist. Die Anamnesedauer ist bei genauer Befragung oft schon lang, sie variiert von 10 Monaten bis zu 3 Jahren, manchmal ist allerdings eine scheinbare Verletzung, eine Distorsion des Gelenks der Anlass, zum Arzt zu gehen und eine Diagnostik zu initiieren.6,7,8 Natürlich sind die Symptome, die z. B. das Kniegelenk betreffen – Schwellung und Schmerzen – schon eher geeignet, frühzeitiger die Diagnose zu stellen. Auch Blockierungserscheinungen des Gelenks im Bewegungsausmaß, eine Überwärmung oder aber klinische Zeichen einer Arthritis können den Untersucher zunächst auf die falsche Fährte locken. „Rheumaknie“, eitrige Arthritis oder aber eine einfache Meniskussymptomatik sind nicht selten auf Überweisungsträgern als Verdachtsdiagnose zu finden. Findet sich die Tumormasse gelegentlich auch extraartikulär, ist der Prozess in der Primärdiagnostik manchmal auch von primären Weichteil-Sarkomen kaum zu unterscheiden.
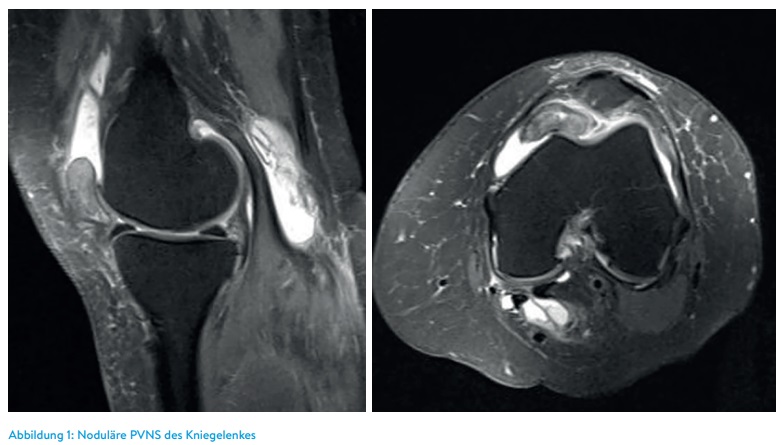
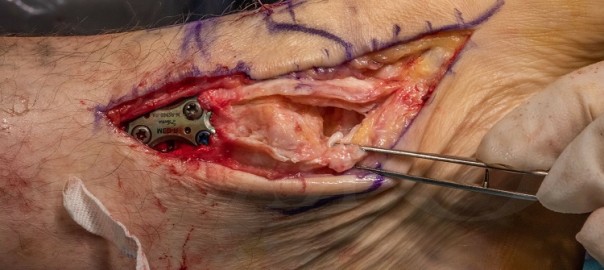
Patienten, die diesen Tumor im Bereich der Finger oder der Zehen haben, kommen oft erst dann in die Praxis, wenn sensible Ausfälle durch Kompression von Nervenästen bestehen oder – im Bereich der Zehen – wenn ein Schuhkonflikt besteht. Allerdings gibt es auch Tumoren der Sehnenscheiden, die völlig asymptomatisch sind und erst bei Erreichen einer störenden Größe zum Arzt führen (Abbildung 2).
Bildgebung
Diese klinischen Veränderungen führen den Untersucher zunächst oft zu einer initialen Sonographie des Gelenks bzw. der Raumforderung. Die Sonographie ist allerdings in aller Regel nicht richtungsweisend. Eine echoreiche inhomogene Masse, eine verdickte Synovia und ein Gelenkerguss können zu vielerlei Diagnosen passen. Sollte die Gelenkschleimhaut multiple spotförmige Veränderungen, darüber hinaus eine zottenartige Auftreibung aufweisen, so kann die Verdachtsdiagnose einer PVNS gestellt werden. Am einfachsten wird da noch die noduläre Form sonographisch detektierbar sein. Eine Dopplersonographie bringt nur sehr selten Anzeichen eines Blutstroms aus
der echogenen Masse.
Die im klinischen Alltag gut verfügbare Röntgenuntersuchung ist nur dann richtungsweisend, wenn bereits durch die Osteoklasten größere subchondrale Defekte entstanden sind, die entgegen arthrosebedingter Zysten nicht nur in der Hauptbelastungszone zu finden sind, sondern ubiquitär vorkommen können. Diese Zysten sind klar und glatt abgegrenzt und weisen nicht selten eine Randsklerosierung auf. Beide Gelenkpartner können gegenüberliegend derlei Veränderungen zeigen. Am auffälligsten sind aber üblicherweise die Weichteilschatten eines ausgeweiteten Gelenks, die bereits in der Nativradiologie eine erhebliche Weichteilformation in den Rezessus vermuten lassen. Allerdings kann eine native Röntgenaufnahme bisweilen auch ein vermeintlich völlig normales und gesundes Gelenk ohne jedwede Pathologika zur Darstellung bringen.
Der goldene Standard ist für die PVNS die MRT-Untersuchung. Sie erlaubt sichere Aussagen über die Ausdehnung der Erkrankung und zum Beispiel in der Darstellung der Sagittalebene auch die Beantwortung der Frage, ob sich extraartikulär oder aber hinter dem hinteren Kreuzband Tumormassen befinden, die dann über einen vorderen Zugang nicht erreicht werden können. Zur Therapieplanung eines offenen Verfahrens ist somit die MRT-Untersuchung unerlässlich.
Die geforderte MRT-Sequenz ist die T2 gewichtete FLASH-3D-Sequenz. Nachweisbar ist eine oft verdickte Synovia sowie ein Kontrastmittelenhancement und Signalveränderungen durch Hämosiderinablagerungen (nach Einblutungen). Der Synovia aufgelagert sind entweder in der monolokulären Form eine glatt begrenzte knotenartige inhomogene Raumforderung oder aber in der multilokulären oder diffusen Form über das gesamte Gelenk verteilt multiple knotige Veränderungen, die sich klar von der Synovia unterscheiden lassen. Die T1-Wichtung kann die umgebende Muskulatur im Vergleich zur Darstellung bringen, hier erscheinen die Noduli in aller Regel isointens. T1- wie auch T2-gewichtete Sequenzen zeigen niedrige bis intermediäre Signalintensitäten in der Darstellung der hämosiderinhalten Noduli.9 Nach Gadolinium-Gabe zeigt sich im Tumor ein sehr heterogenes Enhancement als Zeichen der erhöhten Vaskularität. Zu Beginn der Erkrankung ist die Knorpeldicke in der MRT-Untersuchung noch regulär, später können sich teilweise hoch-degenerative Veränderungen des Knochens, Erosionen und auch Zysten darstellen und eine Arthrose simulieren. Auch beim Riesenzelltumor der Sehnenscheide finden sich oft in enger Nachbarschaft Erosionen des Knochens, die dann in der MRT Untersuchung sehr klar und eindeutig zur Darstellung kommen. Besonders gut lassen sich in der Untersuchung der tenosynvialen Riesenzelltumoren aber die angrenzenden Strukturen, wie Sehnen, Ligamente und neurovaskuläre Strukturen diskriminieren.
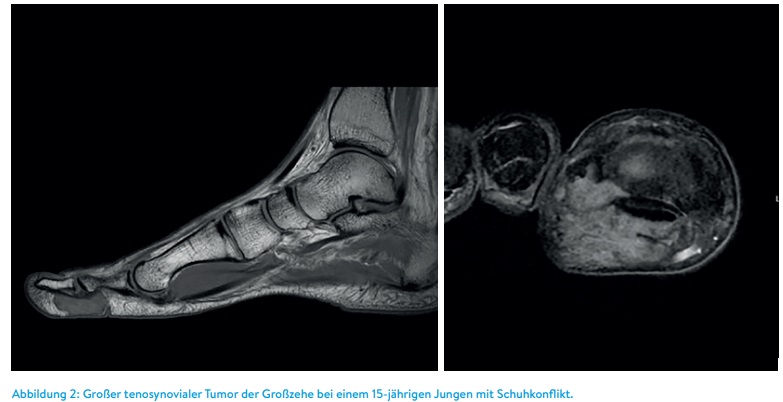
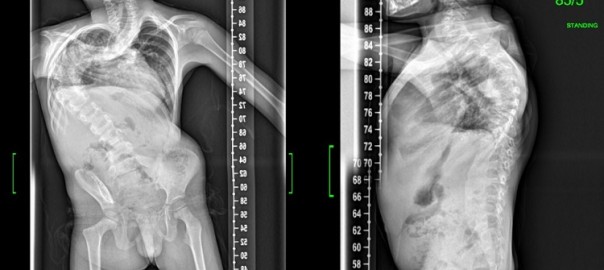
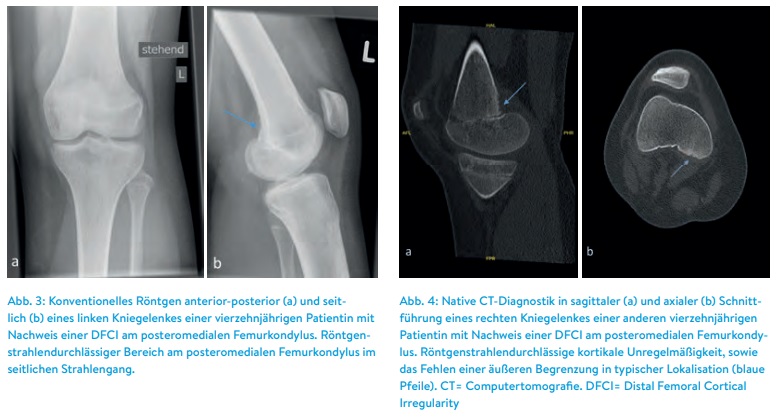
Auch in der Rezidivdiagnostik ist die MRT unerlässlich. Besonders, wenn initiale tumorverdächtige Strukturen nicht von postoperativem Narbengewebe unterschieden werden kann, können wiederholte MRT-Untersuchungen die biologische Aktivität und das Wachstum der Neoplasie beweisen (Abbildung 3).
Der Fluorine 18 Fluorodeoxyglucose (18F-FDG) PET-CT kommt in der Standard-Diagnostik derzeit noch keine richtungsweisende Bedeutung zu; allerdings sind mit zunehmender Erfahrung zukünftig durch diese Art der Bildgebung auch weiterreichende Erkenntnisse zu erwarten.
Therapie
Auch wenn gerade die MRT sehr typisch ist und ein oft klares pathognomonisches Bild zur Darstellung bringt, ist die histologische Sicherung der Neoplasie notwendig. Dabei wird sich die Frage stellen, ob eine histologische Sicherung (z. B. im Kniegelenk) arthroskopisch erfolgen soll (2 Zugänge!) oder aber eine offene Arthrotomie angezeigt ist?
Nach Diagnosesicherung ist die vollständige Resektion des Tumors das anzustrebende Ziel. Nach den MSTS-Kriterien nach Enneking ist allerdings anders als bei malignen Prozessen nicht die weite Resektion erforderlich, sondern es sollte die marginale Resektion angestrebt werden. Beim multifokalen Befall der Synovia ist dies rein anatomisch nicht möglich und auch bei Ummauerung der neurovaskulären Strukturen im Bereich der Akren ist auch oft eine marginale Resektion unter Vermeidung von funktionellen Defiziten kaum möglich und somit nur eine intraläsionale Resektion durchführbar. Es scheint aber mit der Art der Operation – marginal oder intraläsional – das Rezidivrisiko eng zu korrelieren.
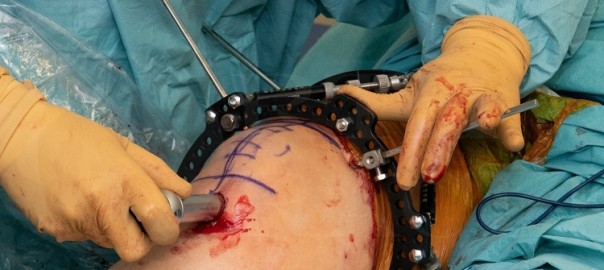
Wir entscheiden uns bei der klassischen monolokulären PVNS in aller Regel für eine offene Arthrotomie und Bergung des Knotens in toto. Damit erscheint uns die Rezidivgefahr geringer zu sein, als bei einer arthroskopischen Auffräsung des Tumors. Dagegen ist bei einer multilokulären Form auch eine arthroskopische Synovektomie durchaus angezeigt. Die arthroskopische Vorgehensweise scheint das Rezidivrisiko etwas zu erhöhen, sodass wir bisweilen auch ein kombiniertes Verfahren, insbesondere bei der diffusen Form anwenden (Abbildung 4).
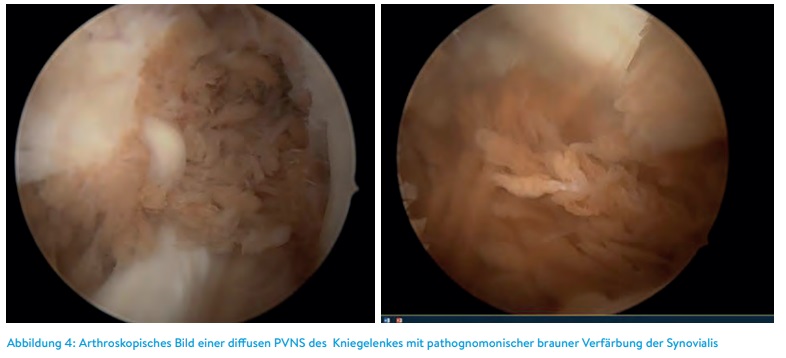
In seltenen Fällen und bei klinischer Asymptomatik findet man bei der Implantation einer Knie-Totalendoprothese teilweise die Synovia mit bräunlichen Herden entsprechend des Vorliegens einer PVNS bedeckt vor. In diesen Fällen ist selbstverständlich bei guter Einsehbarkeit des gesamten Gelenks eine komplette Synovektomie vor Einbau der Prothese in gleicher Sitzung anzustreben.
Die Rezidivrate wird im 10-Jahres-Follow up mit knapp 20 % angegeben.2 Teilweise müssen zahlreiche Nach-Operationen folgen, die letztlich auch die Funktion des Gelenks im Laufe der Jahre stark beeinträchtigen können. Knochenerosionen, Knorpeldefekte und auch die immer wiederkehrenden Synvialisentzündungen machen es manchmal erforderlich schon frühzeitiger als üblich an einen künstlichen Gelenkersatz denken zu müssen. Deswegen ist zu fordern, bereits zu Beginn der Erkrankung anzustreben, eine möglichst optimale Sanierung des Gelenks zu erreichen, um der Rezidivgefahr und der damit in aller Regel verbundenden erhöhten Re-Operationsrate mit immer schwierigerer Ausgangslage entgegen zu wirken. Bei jedweder Verdachtsdiagnose auf einen malignen Prozess ist selbstverständlich zuerst eine Biopsie (nicht-arthroskopisch!) zur Diagnosesicherung erforderlich.
Andere Therapie-Optionen
Bei der Frage einer möglichen Strahlentherapie stehen zwei Verfahren zur Verfügung: die transkutane externe Strahlentherapie und die intraartikuläre Injektion von radioaktiven Istopen wie Yttrium90 (90Y). Die Idee bei der intrartikulären Gabe von radioaktiven Isotopen ist, dass durch eine offene Arthrotomie und durch eine ergänzende Arthroskopie dennoch nicht alle Noduli in der diffusen Form der PVNS erreicht werden konnten und somit das Lokalrezidiv vorprogrammiert ist. Durch die Instillation der radioaktiv beladenen Flüssigkeit wäre damit ja eine Strahlungsquelle gegeben, die das gesamte Gelenk erreicht und somit auch die Areale, die weder offen noch arthroskopisch dem Operateur zugänglich sind. Diese intraartikuläre Gabe darf aber erst frühestens 6 Wochen nach der Operation erfolgen, damit die radioaktive beladene Flüssigkeit nicht unkontrolliert aus dem Gelenk herausläuft und extraartikulär Schäden verursacht.
Bei der transkutanen Bestrahlung hingegen werden Strahlendosen von 30–36 Gy in 14–15 Fraktionen gewählt, die über einen Zeitraum von 3 Wochen appliziert werden können mit dem Ziel der Vermeidung oder Reduktion von Rezidiven ohne aber die Funktionalität des Gelenks zu beeinträchtigen. Allerdings sind bei beiden Verfahren auch Nebenwirkungen und Risiken zu berücksichtigen, wie Schmerzen auf Grund einer strahlungsbedingt entzündeten Synovialis, Hautnekrose, Kniegelenkinfektion mit offener Fistel und andere; auch die Entwicklung von Arthrosen als Strahlenfolge wurde beschrieben.
Letztlich sind diese lang etablierten Verfahren der Strahlentherapie in den letzten Jahren etwas in Verruf geraten, denn einige Studien belegen, dass der erwartete Effekt nicht oder nur in deutlich abgeschwächter Form eingetreten ist, die Rezidivrate nicht verringert werden konnte und auch das klinischfunktionelle Ergebnis nicht das erwartete Resultat erbracht hat. Bei der transkutanen Bestrahlung in der Dosis von 30–36 Gy ist natürlich auch das Risiko von Langzeitschäden wie strahlenbedingter Tumorentwicklung insbesondere bei jüngeren Patienten zu diskutieren, zumal es sich bei der PVNS letztlich um eine benigne Erkrankung handelt.
Medikamentöse Therapie
Neuere Daten lassen etwas Hoffnung aufkommen auf eine adjuvante medikamentöse Behandlungsmöglichkeit. Teilweise noch laufende Studien mit der Therapieoption von Tyrosin- Kinase Inhibitoren wie z. B. Imatinib, Pexidartinib, Emactuzunab und Nilotinib, die CSF1 blockieren können und damit die Tumoraktivität bremsen, werden derzeit in operativ schlecht beherrschbaren Rezidiv-Situationen angewandt und machen vielleicht in Zukunft die Behandelbarkeit von Patienten mit zahlreichen Rezidiven einfacher. Es gilt allerdings noch das Ziel im Auge zu behalten, wie die doch zahlreichen möglichen Nebenwirkungen dieser Chemotherapeutika beherrscht werden können.
Zusammenfassend ist die PVNS bzw. der tenosynoviale Riesenzelltumor eine Neoplasie mit einer hohen Variabilität und einem sehr unterschiedlichen Erscheinungsbild. Die noduläre oder monolokuläre Form der Erkrankung ist oft gut beherrschbar und therapeutisch gut angehbar. Die diffuse Form stellt uns teilweise vor große Herausforderungen, und auch wenn andere Therapieoptionen zu diskutieren sind, ist derzeit die Therapie der Wahl die möglichst konsequente chirurgische Sanierung des Gelenkes bzw. der befallenen Strukturen. Es gilt die Rezidivgefahr zu minimieren und die Funktionalität des Gelenks oder der Struktur zu bewahren. Im Falle eines Zweifels hinsichtlich der Dignität der Läsion ist immer auch eine Biopsie zu fordern. Eine Vorstellung in einem Zentrum mit besonderer Expertise in der Behandlung von benignen und malignen Tumoren kann manchmal helfen, unliebsame Verläufe der Erkrankung zu vermeiden.
Literatur auf Anfrage bei der Redaktion.













 Osteoporose, Knochenmarködem, Pseudarthrose, vermindertes Wachstum – wussten Sie, dass die Ursache dafür eine erbliche Knochenmineralisierungsstörung sein kann?.[1] Hypophosphatasie (HPP) führt bei Patient:innen u. a. zu den unterschiedlichsten osteologischen Symptomen.[1,2,3,4] Insbesondere Stressfrakturen, Osteomalazie und Frakturheilungsstörungen werden jedoch oft als Anzeichen einer Osteoporose verkannt.[5,6] Lernen Sie, die Anzeichen für HPP zu erkennen:
Osteoporose, Knochenmarködem, Pseudarthrose, vermindertes Wachstum – wussten Sie, dass die Ursache dafür eine erbliche Knochenmineralisierungsstörung sein kann?.[1] Hypophosphatasie (HPP) führt bei Patient:innen u. a. zu den unterschiedlichsten osteologischen Symptomen.[1,2,3,4] Insbesondere Stressfrakturen, Osteomalazie und Frakturheilungsstörungen werden jedoch oft als Anzeichen einer Osteoporose verkannt.[5,6] Lernen Sie, die Anzeichen für HPP zu erkennen:

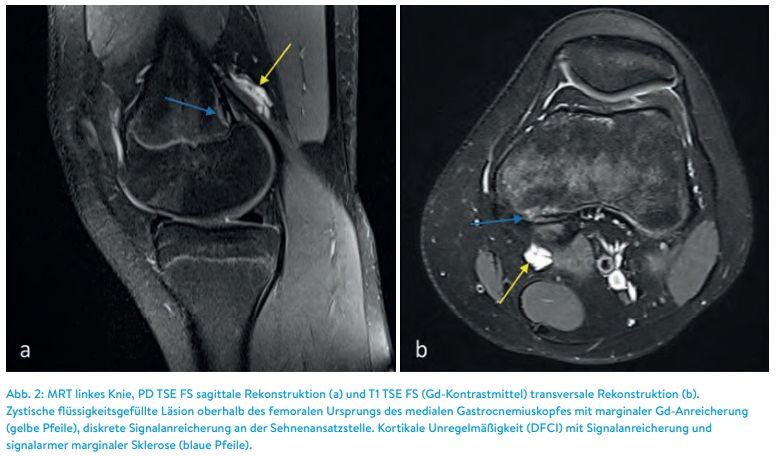
 Fazit für den Alltag:
Fazit für den Alltag: