Im Oktober 2024 entschied sich Herr Dr. med. Dino Schulz für die Implementierung der SCS Bildgebung. Die orthopädische Praxis Piusallee kann Patienten mit diesem Diagnoseverfahren eine genauere und zielgerichtete Therapie bieten.
Zusammenfassung:
In der orthopädischen Praxis Piusallee setzt das Team auf innovative Technik, um die Diagnosesicherheit und den Patientenkomfort zu maximieren. Präzisere Befunde direkt in der Praxis – ohne lange Wartezeiten oder Überweisungen – definieren seit der Implementierung der SCS Bildgebung den Arbeitsalltag.
Diese Technologie ermöglicht eine hochauflösende 3D-Schnittbildgebung mit minimaler Strahlenbelastung und übertrifft herkömmliche Röntgen- und CT-Verfahren besonders bei Frakturen und bei der Implantatkontrolle. Auch die Patienten der Praxis verspüren einen deutlichen Mehrwert durch das neue Diagnostikverfahren. Sie begeistert die schnelle Durchführung, die bequemere Positionierung und der Fakt, Befunde aufgrund der einfachen Darstellung leichter nachvollziehen zu können.
Diese Art der Diagnostik spricht sich unter den Patienten in der Region immer mehr herum. So kommt es inzwischen häufiger vor, dass viele Patienten die Praxis gezielt wegen dieser modernen Diagnostik aufsuchen.
Das Erfolgsrezept einer effizienten Praxis, die immer wieder gern von Patienten aufgesucht wird, liegt in einer fortschrittlichen Diagnostik und einer rundum fürsorglichen, qualitativ hochwertigen Behandlung. Alte Systeme, die dazu nicht beitragen, können ein Grund für schwindendes Vertrauen auf Seiten der Patienten sein.
In der orthopädischen Praxis Piusallee sollen sich Patienten während Ihres Aufenthalts und der Untersuchung stets wohl und an erster Stelle kommend fühlen. Dazu gehört für den Facharzt für Orthopädie und Unfallchirurgie, Dr. med. Dino Schulz, die vollumfängliche Versorgung.
Seit über zehn Jahren behandelt das Team aus Münster seine Patienten auf höchstem Niveau. Zum ärztlichen Team zählen neben Herrn Dr. Schulz seine Kolleginnen Frau Dr. med. Kathleen Herrmann, Frau Dr. med. Eva Wilhelmer und Kollege Herr Prof. Dr. med. Hans-Henning Wetz. Das Quartett deckt das gesamte Spektrum der konservativen Orthopädie und Unfallchirurgie ab. Neben dem Hauptstandort betreibt die Praxis eine Zweigstelle im Stadtteil Roxel sowie ein Analysezentrum, das sich auf Wirbelsäulen- und Haltungsanalysen spezialisiert hat.
Um die medizinische Versorgung seiner Patienten noch effektiver und sicherer zu gestalten, entschied sich Herr Dr. Schulz im Oktober 2024 für die Implementierung der SCS Bildgebung am Hauptstandort.
Erfahren Sie in einem ausführlichen Interview mehr darüber, wie das Team von Herrn Dr. Schulz diese hochwertige Lösung im Praxisalltag nutzt und Patienten den Einsatz dieser Diagnostik schätzen.

Innovative Technologie prägt die Versorgung
Eine moderne Praxis arbeitet mit effizienten Methoden, die das Wohl des Patienten in den Vordergrund stellen und Prozesse optimieren. Veraltete Diagnoseverfahren können nicht nur die eigene Befundsicherheit, sondern auch den gesamten Praxisworkflow beeinflussen. Die SCS Bildgebung löst solche Probleme mit Leichtigkeit. Herr Dr. med. Dino Schulz setzt auf fortschrittliche medizinische Verfahren, die seine Praxis sinnvoll ergänzen.
„Innovation steht bei uns in der Praxis im Mittelpunkt, denn das Wohl unserer Patienten hat oberste Priorität. Die SCS Bildgebung hat uns deswegen so überzeugt, weil wir den Patienten vor Ort eine hochpräzise Diagnostik anbieten können – ganz ohne Überweisungen.“
Die SCS Bildgebung definiert Sicherheit neu
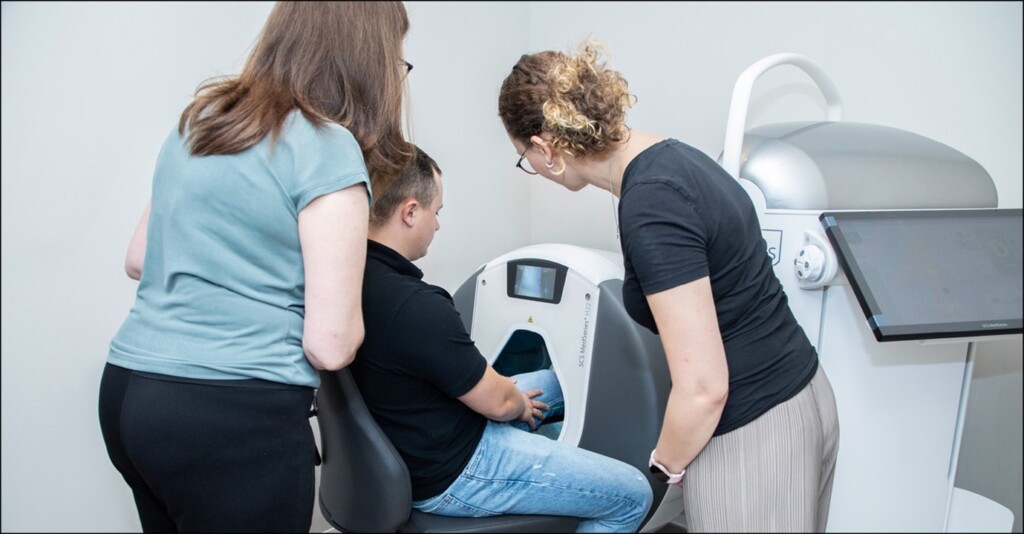
Zu einer rundum angenehmen Diagnostik, bei der der Patient im Fokus steht, zählt zum einen die einfache Lagerung und die unmittelbare Therapiefindung während der Erstvorstellung. Zum anderen steht auch die Sicherheit an oberster Stelle. Mit der SCS Bildgebung erstellen Ihre Mitarbeiter Bildergebnisse, die immer gelingen – und das nicht nur durch die einfache Positionierung der Patienten. Im Vergleich zu den herkömmlichen Diagnoseverfahren erzielt die SCS Bildgebung eine wesentlich höhere Auflösung und ermöglicht dadurch die präzise Darstellung kleinster Haarrisse oder Fissuren.
„Mit der SCS Bildgebung lassen sich Frakturen in ihrer Stellung viel genauer beurteilen. Das 2D-Röntgen ist dagegen kein Vergleich. Das DVT besticht selbst das CT, indem es zum Beispiel eine viel bessere Artefaktunterdrückung aufweist.“
Herr Dr. Schulz berichtet, dass die eingesetzten Implantate beim CT trotz der Artefaktunterdrückung nur mit 3 bis 4 Millimeter Überstrahlung sichtbar sind, sodass es schwierig ist, die Frakturheilung optimal zu beurteilen.
„Bei der Implantatkontrolle ist die SCS Bildgebung mit ihrer exzellenten Bildqualität wegweisend für uns, denn durch sie können wir den Heilungsprozess optimal verfolgen und dem Patienten eine bessere Einschätzung geben.“
Diese Meinung teilt auch Frau Dr. Wilhelmer, Fachärztin für Orthopädie und Unfallchirurgie: „Am meisten begeistert mich, dass es mir komplett neue Möglichkeiten zur Diagnostik und Therapie von Patienten mit v.a. verzögerter Frakturheilung bei liegendem Osteosynthesematerial oder zum Ausschluss einer Prothesenlockerung bietet.
Die Artefaktunterdrückung zusammen mit der hohen Auflösung eröffnet mir immer wieder neue Möglichkeiten, meine Patienten adäquat zu beraten und behandeln.“
Dank der multiplanaren Schnittbildgebung, die die SCS Bildgebung in 0,2 mm Schichtdicke anfertigt, können ossäre Veränderungen deutlich sichtbar gemacht werden. Dadurch steigt die Aussagekraft der erstellten Aufnahmen enorm und führt gleichzeitig zu einer stärkeren Befundsicherheit.
Frau Dr. med. Kathleen Herrmann, Fachärztin für Handchirurgie, schätzt diesen Aspekt der Lösung sehr:
„Die SCS Bildgebung hilft mir dabei, selbst kleinste Strukturen in hochauflösenden 3D-Schnittbildern darzustellen, die im 2D-Röntgen so nicht gesehen werden können. Das steigert meine Diagnosesicherheit und im weiteren Verlauf kann die Planung der anschließenden Therapie optimal erfolgen.“

Patienten schätzen die hochwertige Diagnostik
Die komplizierte Lagerung der Patienten ist für das 2-D-Röntgen integral, um brauchbare Bildergebnisse zu erzeugen. Bei der Untersuchung mit der SCS Bildgebung positioniert das Personal Ihre Patienten hingegen in räumlich freier Umgebung. So können Sie nach jeder Untersuchung auf aussagekräftige und planungssichere 3D-Aufnahmen vertrauen.
Die hochwertigen Ergebnisse liegen Ihnen unmittelbar zur Befundung und Besprechung mit den Patienten vor, sodass noch innerhalb der Erstvorstellung eine individuell angepasste Therapie begonnen werden kann. Davon sind auch die Patienten der orthopädischen Praxis Piusallee begeistert und Herr Dr. Schulz freut sich besonders über das positive Feedback:
„Die Patienten schätzen diese neue Art der Diagnostik in unserer Praxis sehr. Ihnen gefällt die Schnelligkeit der durchgeführten Untersuchung. Ich wundere mich manchmal selbst darüber, wie schnell eine solche Aufnahme angefertigt wird.“
Auch die Möglichkeit, die aufschlussreiche 3D-Rekonstruktion im Besprechungszimmer am Monitor zu zeigen, hat einen positiven Einfluss. Sie erleichtert das Verständnis für den Befund und die Nachvollziehbarkeit für die gewählte Therapie.
„Die modernen Möglichkeiten einer angenehmeren Untersuchung, die einer Praxis heute zur Verfügung stehen, faszinieren unsere Patienten.“
Die Praxis von Herrn Dr. Schulz ist in Münster die erste, die über die innovative SCS Bildgebung verfügt. Anhand eines Zeitungsartikels und über Flyer für das Wartezimmer konnte er seine Patienten auf das Angebot dieser Lösung erstmalig aufmerksam machen. Inzwischen hat sich die Verfügbarkeit auch unter den Patienten herumgesprochen – etwas, das sich im Alltag bemerkbar macht. Herr Dr. Schulz berichtet, dass viele Patienten inzwischen gezielt seine Praxis aufsuchen, weil sie von der positiven Resonanz der 3D-Schnittbildung gehört haben.
Zusätzlicher Schutz dank geringer Strahlendosis
Die angewandte Strahlendosis bleibt trotz der hohen Bildauflösung sehr gering, denn das SULD (Super-Ultra-Low-Dose) Protokoll senkt die Strahlung auf ein Minimum.
„Der Schutz unserer Patienten liegt dem Team am Herzen. Die geringe Strahlendosis der SCS Bildgebung war daher einer der vielen ausschlaggebenden Punkte, die zur Implementierung geführt hatte.“
Die Kombination aus exzellenter Bildqualität und geringer Strahlendosis macht die SCS Bildgebung zu einem wertvollen Diagnosetool, das die Ärzte bei der Versorgung der Patienten enorm unterstützt, so Frau Dr. Herrmann. „Diese Lösung liefert mir hochauflösende, detailgenaue 3D-Schnittbilder, die es unter Einsatz minimaler Strahlenbelastung ermöglicht, eine präzise Diagnostik durchzuführen.“
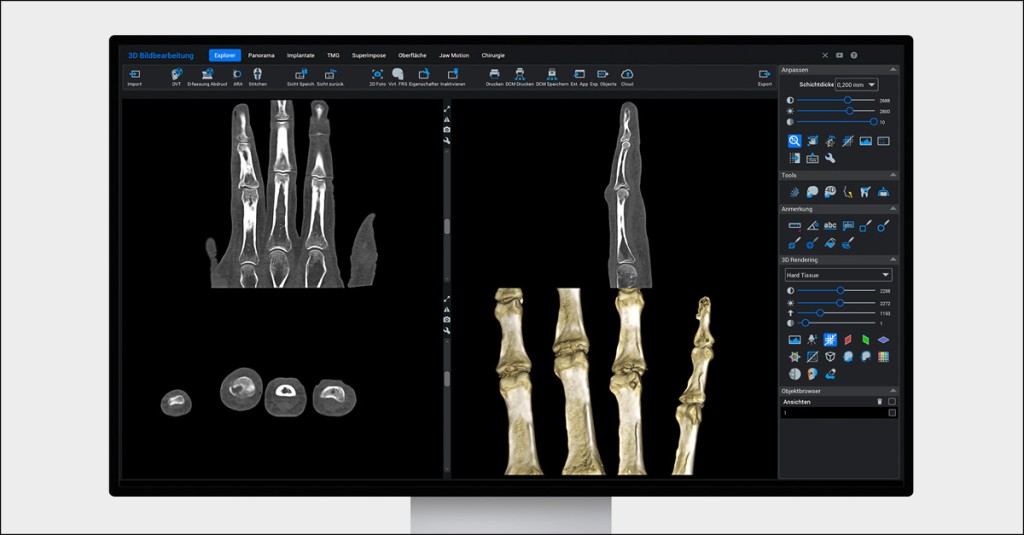
Praxisbeispiel: Die SCS Bildgebung liefert Klarheit über Fraktur
All die genannten Vorteile tragen dazu bei, Patienten zielführend zu versorgen und ihnen schnell eine passende Therapie zukommen zu lassen. Herr Dr. Schulz nennt dazu ein Beispiel aus seiner Praxis, das zeigt, wie wertvoll eine solch hochwertige Diagnostik im Praxisalltag ist. In der orthopädischen Praxis Piusallee stellte sich eine Patientin vor, die im Skiurlaub gestürzt war und sich dabei eine Verletzung am Finger zugezogen hatte. Zunächst wurde ein Röntgenbild angefertigt, doch aus den Aufnahmen ging nicht klar hervor, ob es sich hierbei um eine Arthrose oder eine Fraktur handeln könnte.
„Um wirklich sicher zu gehen, dass es sich hierbei um eine Fraktur handelte, rieten wir der Patientin zu einer Untersuchung mittels SCS Bildgebung. Erst in diesen Aufnahmen wurde das Ausmaß der Verletzung klar. Es zeigte sich eine ulnare Impressionsfraktur des Mittelglieds, die eine operative Konsequenz nach sich zog.“
Die operative Versorgung mit einem Distraktionsfixateur erfolgte in einem naheliegenden Krankenhaus und der Patientin geht es gut. Die Verlaufskontrolle wird in Kürze ebenfalls mit der SCS Bildgebung durchgeführt.
„Mit Fällen, in denen die korrekte Diagnose erst durch die SCS Bildgebung gestellt werden kann, haben wir täglich zu tun.“
Die richtige Entscheidung für die Praxis
Die SCS Bildgebung hat in der orthopädischen Praxis Piusallee für einschneidende positive Veränderungen gesorgt und das Team zeigt sich von dieser Lösung und ihrem diagnostischen Mehrwert begeistert.
„Wir haben mit der SCS Bildgebung nur positive Erfahrungen gemacht – schon ab der ersten Minute. Von der Planung, über die Installation und Durchführung in der Praxis sowie die Schulungen haben hervorragend funktioniert.“
Herr Dr. Schulz zeigt sich auch von der Betreuung begeistert und kann sich den Praxisalltag ohne die hochwertige 3D-Bildgebung nicht mehr vorstellen. Er ist dankbar für die Hilfestellung, die er zu sämtlichen Themen und Fragen bekommen hat und spricht sich daher für eine Empfehlung aus.
„Die Erwartungen haben wir im ersten Quartal deutlich übertroffen. Aus meiner Sicht spricht nichts gegen die Installation eines solchen Systems. Es gibt eigentlich nur Gründe, die für die SCS Bildgebung sprechen. Ich möchte meine Kollegen aus der O&U aufgrund dieser überzeugenden Bildqualität und der niedrigen Strahlenbelastung dazu animieren, sich mit dieser Lösung auseinanderzusetzen.“
orthopädische praxis piusallee
Dr. med. Dino Georg Schulz
Piusallee 34
48147 Münster
www.oppms.de
Sie haben individuelle Fragen zur innovativen SCS Bildgebung?
Wir begleiten Sie von Anfang an und unterstützen Ihre Transformation von der 2D- auf die moderne 3D-Diagnostik. Ihnen steht jederzeit ein persönlicher Ansprechpartner für alle Fragen zum technischen, wirtschaftlichen und medizinischen Betrieb zur Verfügung. Haben wir Ihr Interesse an unserer 3D-Bildgebung geweckt?
Lassen Sie sich in einem ersten, etwa 15-minütigen Telefonat beraten. In einem Gespräch zeigen wir Ihnen Ihre Möglichkeiten der hochmodernen Diagnostik auf.