Betrachtung des Einsatzspektrums und der Strahlenhygiene
Die Diagnostikmethoden Projektionsradiographie, Sonographie, Multi Slice CT (MSCT) oder MRT sind in Deutschland seit Jahrzehnten im Bereich der Orthopädie und Unfallchirurgie (O&U) etabliert, um den im Praxisalltag typischerweise auftretenden klinischen Fragestellungen auf den Grund zu gehen. Die übliche, stetig fortschreitende technologische Weiterentwicklung hat unterdessen die Diagnostikmöglichkeit mit der Bezeichnung „Digitale Volumentomographie“ (DVT) oder in wissenschaftlichen Publikationen als „Cone Beam CT“ (CBCT) beschrieben, hervorgebracht. Die DVT wurde für den Einsatz im Bereich der O&U mit ihren spezifischen Anforderungen und dem Anspruch einer sehr hohen resultierenden Strahlenhygiene entwickelt.
Diese Diagnostik ist für die Hochkontrast-Darstellung optimiert und auf Basis des breiten Indikationsspektrums seit dem ersten Einsatz in der O&U vor nunmehr 10 Jahren für das Fachgebiet unverzichtbar geworden. Die DVT findet nach Erlangung der dazu erforderlichen Fachkunde im Strahlenschutz immer dann ihren Einsatz, wenn zu erwarten ist, dass die Diagnostikmethoden Projektionsradiographie, CT, MRT etc. zur Beantwortung ossärer Veränderungen an ihre individuellen Grenzen kommen, während gleichzeitig Fragen zur vorliegenden Indikationsstellung offenbleiben würden. Eine detailliertere Betrachtung der Diagnostikmöglichkeiten soll nachfolgend aus medizinphysikalischer sowie fachkundiger, ärztlicher Sicht erfolgen.
Die etablierten Diagnostikmöglichkeiten
Die in der O&U verfügbaren Diagnostikmöglichkeiten haben jede für sich ihre Wertigkeit, besitzen jedoch Einschränkungen im Bereich der im Fachgebiet häufig erforderlichen Anforderung zur Beurteilung ossärer Strukturen sowie deren Lage zueinander. Während die Projektionsradiographie im Vergleich zum MSCT mit einer deutlich geringeren, resultierenden Strahlenbelastung einhergeht, lassen die hier bereitgestellten Informationen durch deren Summation in den Projektionen nur eingeschränkte Aussagen zu und haben im Vergleich zu einer Schnittbilddiagnostik deutlich das Nachsehen [1, 2]. Die Sonographie erlaubt in ihren Dimensionen nur örtlich eingeschränkte Einsichten und hat sich im genannten Anwendungsfeld dadurch häufig nur als additive Diagnostik etabliert. Das MSCT ist der Projektionsradiographie bspw. in der Frakturdetektion überlegen, daraus resultiert jedoch eine deutlich höhere Strahlenbelastung. Zudem ist das MSCT im Praxisalltag meist nur in Auflösungen von mehr als 1 mm verfügbar und kann in keinem Anwendungsfall die oft wichtigen Aufnahmen unter Belastung bereitstellen. Diese Möglichkeit bieten eingeschränkt verfügbare MRT-Systeme, wobei alle Systeme gleichermaßen auf Basis der Spezialisierung zur Weichteildarstellung nur eingeschränkte Aussagen über ossäre Strukturen zulassen, was u.a. an die meist nur zwischen 1-3 mm verfügbare Auflösung geknüpft ist.
Moderne Technologie
Vor dem Hintergrund der beschriebenen Einschränkungen des MSCT, MRT etc., sowie der Anforderungen in der O&U, wurde die DVT für das Fachgebiet entwickelt und fand hier ihren ersten Einsatz in Deutschland vor ca. 10 Jahren. Hierbei gewährleistet die DVT multiplanare Schnittbildinformationen bspw. der Extremitäten sowie der HWS. Dabei stellt diese nach Wahl des Anwenders Aufnahmen innerhalb von ca. 20 Sekunden unter natürlicher Körperbelastung oder Entlastung mit einer hohen Auflösung in allen Raumrichtungen von 0,2 mm bereit. Seit dem Zeitpunkt der ersten Implementierung wurde das DVT aufgrund des breiten Indikationsspektrums in zahlreichen wissenschaftlichen Arbeiten beleuchtet und dessen Wertigkeit im Einsatz der O&U sowie im Vergleich zu den gängig verfügbaren Diagnostikmethoden mehrfach bestätigt [3 – 6].
Super-Ultra-Low-Dose
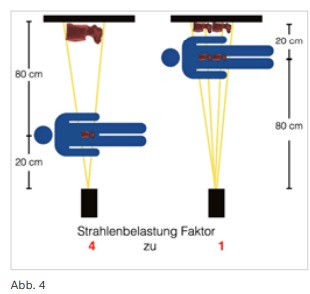
Zudem wurde u.a. die Strahlenhygiene eines DVT analog den Anforderungen in der O&U in den letzten Jahren einer stetigen Weiterentwicklung unterzogen, wodurch den Anwendern heute ein Super-Ultra-Low-Dose (SULD) Aufnahmepreset zur Verfügung gestellt werden kann. Dieses besitzt den Vorteil, dass die resultierende Strahlendosis unter der eines im O&U-Einsatz typischen, digitalen Projektionsröntgen in 2 Ebenen einzuordnen ist. Zur Entwicklung des SULD-Preset wurde die resultierende effektive Dosis ermittelt und mit dem Projektionsröntgen in zwei Ebenen, sowie mit typischen, im Rahmen der O&U eingesetzten MSCT-Systemen (Messungen jeweils unter gleichen wissenschaftlichen Bedingungen) verglichen. Die Ergebnisse können den Abbildungen 5 bis 8 für die Bereiche Ellenbogen, Handgelenk, Kniegelenk und Sprunggelenk entnommen werden und belegen die sehr hohe Strahlenhygiene unter Anwendung des SULD-Presets.
Es konnte nachgewiesen werden, dass die resultierende effektive Dosis gegenüber dem MSCT in den Bereichen Handgelenk um 92,4 %, Kniegelenk um 91,6 %, Sprunggelenk um 93,5 % sowie Ellenbogen um 97,3 % geringer liegt. Auch ist die resultierende effektive Dosis gegenüber dem Projektionsröntgen in 2 Ebenen in den Bereichen Handgelenk um 31,6 %, Kniegelenk um 23,3 %, Sprunggelenk um 6,7 % und Ellenbogen um 33,3 % geringer.
Der Vergleich mit dem Projektionsröntgen in 2 Ebenen wurde zudem in einer losgelösten Studie von einer anderen Forschergruppe im Bereich des Handgelenks unter Betrachtung der Energiedosis durchgeführt. Hier wurde eine um 13,2 % niedrigerer Energiedosis bei gleichzeitig einer im Durchschnitt um 28 % höheren Wahrscheinlichkeit zur Frakturfindung im Vergleich zu dem Projektionsröntgen in 2 Ebenen ermittelt und damit die grundlegend geringere Dosis sowie höhere Wertigkeit des untersuchten DVT unter Anwendung des SULD-Preset zur Beurteilung ossärer Strukturen verifiziert [7].
Die bessere Wahl für Patient, Arzt und Praxis
Der Einsatz der DVT kann auf Basis der genannten Eigenschaften insbesondere bei vorhandenem SULD-Preset und damit verbundener hoher Strahlenhygiene innerhalb eines breiten Indikationsspektrums stattfinden. Die DVT-Aufnahmen unterstützen die möglichst schnelle Genesung des Patienten durch eine Therapiewahl, die auf Basis hochauflösender, ossärer Bildinformationen ohne Projektionsverluste ggf. additiv mit MRT- oder Sonographieergebnissen getroffen werden kann. Vor diesem Hintergrund wird in der Praxis von Dr. Glatzel seit November 2020 ein DVT angewendet, dessen vorhandenes SULD-Preset in 100 % der Fälle Anwendung findet. Im Folgenden werden Fallbeispiele aus der täglichen Praxis aufgezeigt, die die sinnvolle Ergänzung der Diagnostikmethoden wie bspw. Sonographie oder MRT bzw. den Ersatz der Projektionsradiographie und CT durch die digitale Volumentomographie aufzeigen.
Fall 1
Nicht-dislozierte Fraktur des Radiusköpfchens
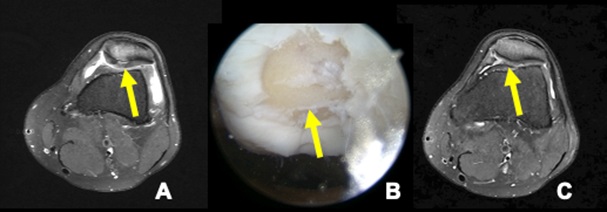
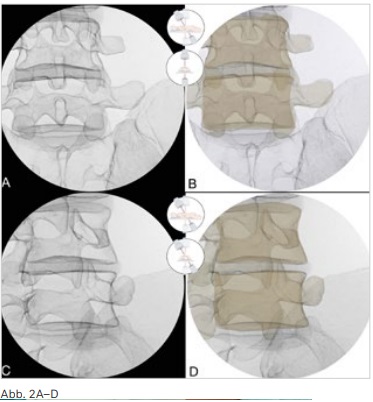
63-jähriger Patient mit Sturz am Vortag vom Fahrrad auf den ausgestreckten Arm. In der kernspintomographischen Abklärung findet sich eine Radiusköpfchenfraktur mit Knochenmarködem, vermutlich Gelenkflächenverletzung und periartikulärem Hämatom. Nachdem auf Basis der MRT-Aufnahme die Weichteilverletzungen, jedoch nicht die Fragestellung der evtl. OP-pflichtigen Versorgung suffizient beantwortet werden konnte, wurde zusätzlich eine DVT des rechten Ellenbogens unter Anwendung des SULD-Preset durchgeführt (siehe Abb. 1), wobei die Aufnahme mit 0,2 mm Auflösung eine klar nichtdislozierte Fraktur des Radiusköpfchens Mason II zeigte. Die Fraktur ist konservativ in gleicher Stellung ausgeheilt.
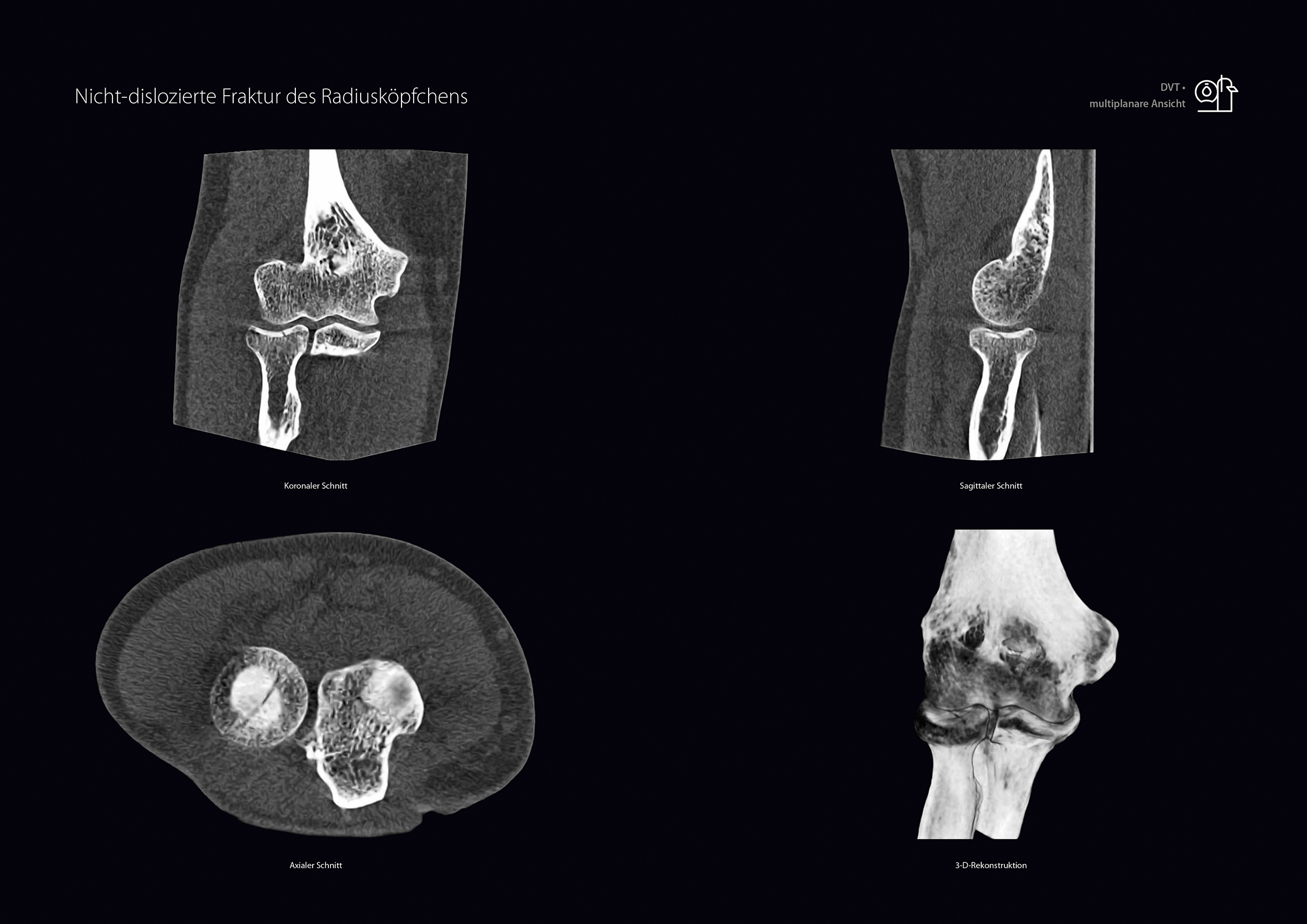 Abbildung 1: 63-jähriger Patient mit Sturz am Vortag vom Fahrrad auf den ausgestreckten Arm.
Abbildung 1: 63-jähriger Patient mit Sturz am Vortag vom Fahrrad auf den ausgestreckten Arm.
Fall 2
Osteochondraler Defekt des medialen Femurcondylus mit freien Gelenkkörpern
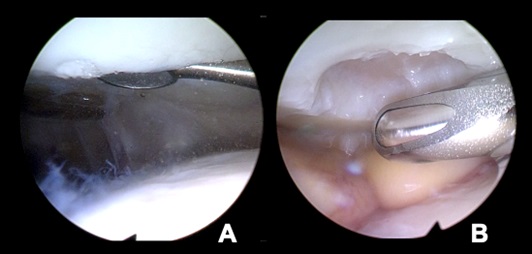
27-jähriger Patient mit neu aufgetretenen medialen Knieschmerzen ohne Trauma. Bei V.a. mediale Meniscopathie wurde eine MRT des linken Kniegelenkes angefertigt, die einen großen osteochondralen Defekt des medialen Femurkondylus zeigte. Zur vollständigen Beurteilung der ossären Veränderungen wurde eine DVT mit SULD-Preset angefertigt (siehe Abb. 2). Die Schnittbilder mit 0,2 mm isotroper Auflösung zeigten noch ortsständige freie Gelenkkörper und einen Sklerosierungssaum der Defektzone. Der Patient wurde einer weiteren arthroskopischen Diagnostik mit Exploration des Defektes, Gelenkkörperentfernung und ggfs. ACT zugeführt.
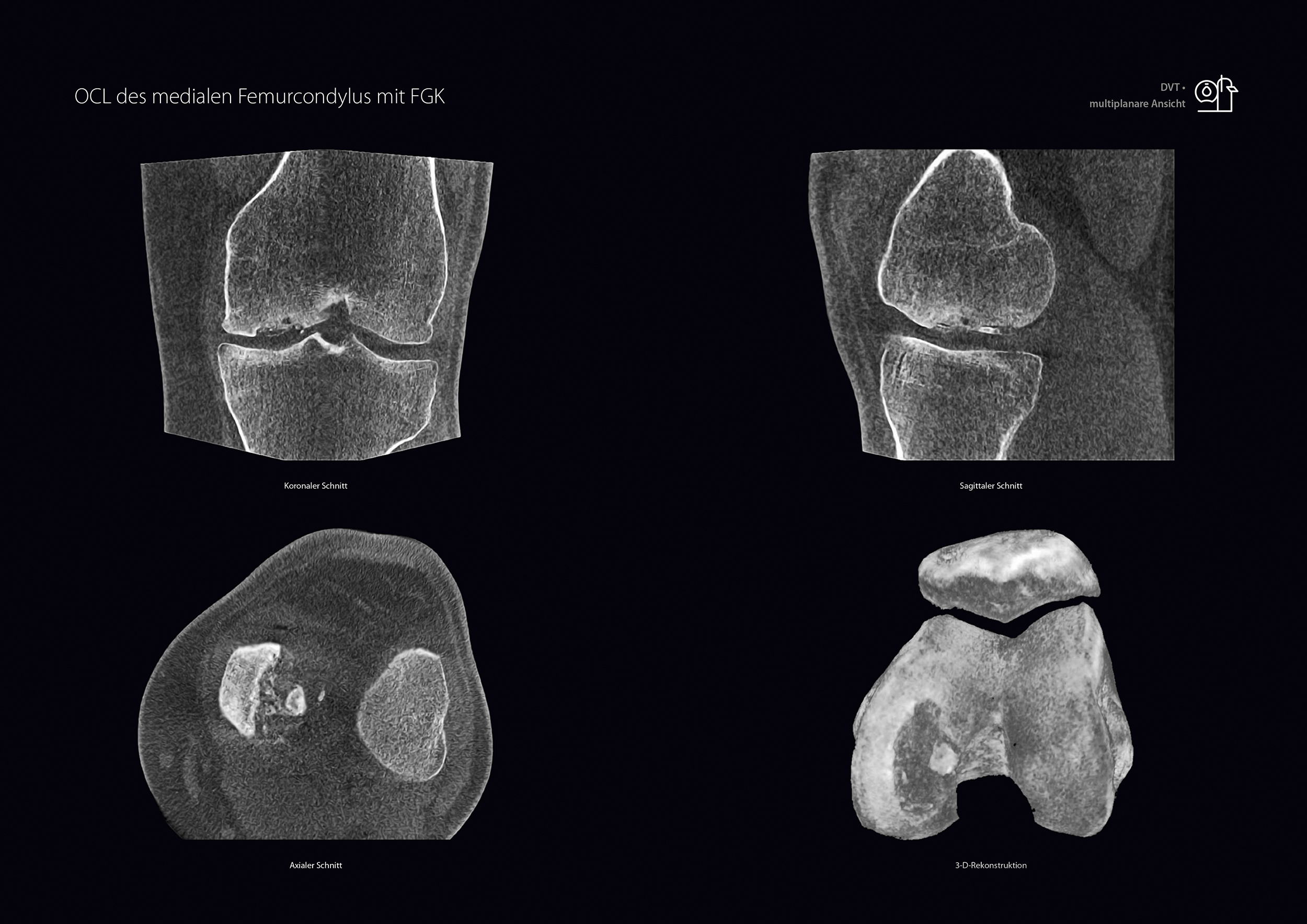
Abbildung 2: 27-jähriger Patient mit neu aufgetretenen medialen Knieschmerzen ohne Trauma.
Fall 3
Mediale Taluskantenfraktur mit freiem Gelenkkörper
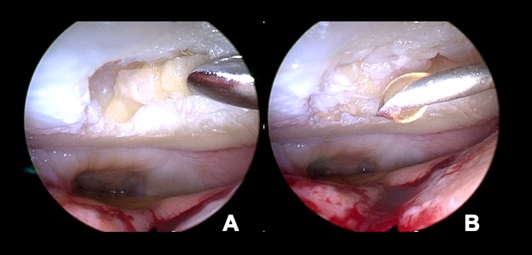
36-jähriger Patient mit einem Pronationstrauma beim Fußball durch Fremdeinwirkung vor ca. 10 Wochen. Bei der kernspintomographischen Aufklärung fand sich ein Knochenmarködem der medialen Talusschulter bei intaktem Kapsel-Bandapparat. Zur weiteren Abklärung der ossären Veränderungen wurde eine DVT im SULD-Preset durchgeführt (siehe Abb. 3), in der sich ein ausgeheilter Zustand nach medialer Taluskantenabsprengung in leichter Fehlstellung mit additivem freien Gelenkkörper zeigte. Infolgedessen wurde der Patient einer Arthroskopie mit Debridement, Gelenkkörperentfernung und Mikrofrakturierung zugeführt.

Abbildung 3: 36-jähriger Patient mit einem Pronationstrauma beim Fußball durch Fremdeinwirkung.
Fall 4
Spontan weitgehend konsolidierte Frakturen des Talus, Calcaneus und Cuboideums mit Gelenkflächenbeteiligung
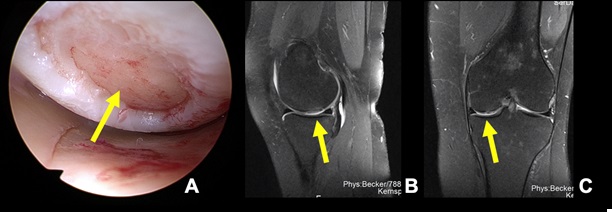
52-jährige Patientin mit 5 Wochen zurückliegendem Supinationstrauma des rechten Sprunggelenkes in der Karibik, das bisher keiner weiteren Diagnostik zugeführt wurde. Die MRT fand keine relevante Kapsel-Band- oder Syndesmosenverletzung aber Knochenmarködeme in Talus, Calcaneus und Os cuboideum mit Frakturlinien. Zur sicheren Abklärung der ossären Verletzungen ist eine DVT mit SULD-Preset erfolgt (siehe Abb. 4). Hier zeigten sich schon spontan weitgehend konsolidierte Frakturen mit Gelenkflächenbeteiligung der o.g. Knochen, die nach dem in der DVT bestimmbaren, vorliegenden Durchbauungsgrad als stabil eingestuft werden konnten, weshalb eine funktionelle Belastung erlaubt wurde.
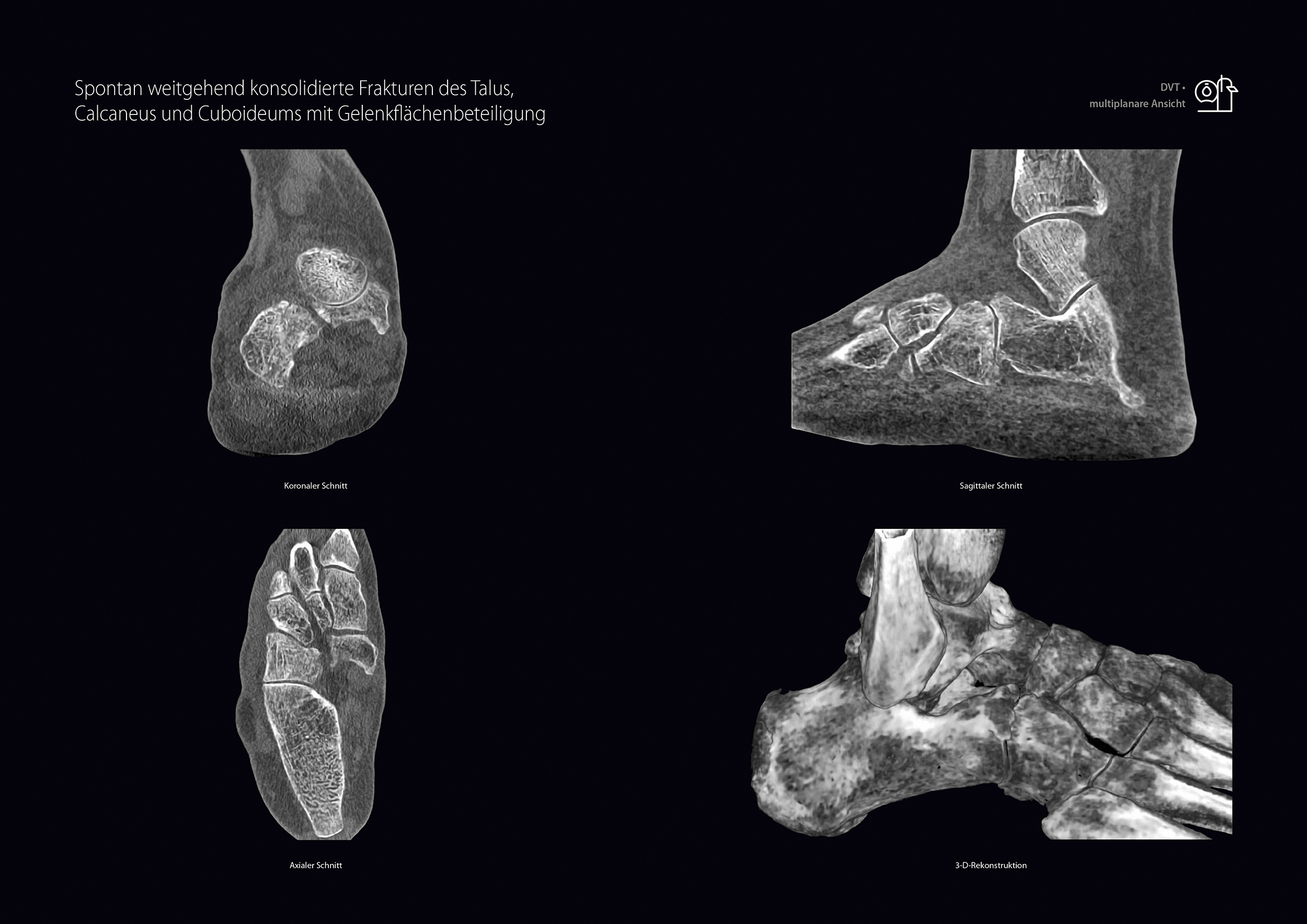 Abbildung 4: 52-jährige Patientin mit 5 Wochen zurückliegendem Supinationstrauma des rechten Sprunggelenkes.
Abbildung 4: 52-jährige Patientin mit 5 Wochen zurückliegendem Supinationstrauma des rechten Sprunggelenkes.
Fazit:
Die DVT kann auf Basis einhergehender Eigenschaften wie die Möglichkeit zur Durchführung von wahlweise be- oder entlasteten Aufnahmen, einer Auflösung von 0,2 mm Schichtdicke, der sehr geringen Aufnahmezeit von ca. 20 Sekunden sowie der sehr hohen Strahlenhygiene – insbesondere bei Verfügbarkeit des SULD-Preset – im Bereich der Orthopädie und Unfallchirurgie den Ersatz der Projektionsradiographie sowie des MSCT darstellen und sinnvoll mit der Aussage über Weichgewebe mit dem MRT ergänzt werden. Die höhere Strahlenhygiene eines DVT mit verfügbarem SULD-Preset konnte im Vergleich zu dem Projektionsröntgen in 2 Ebenen sowie zu dem Multi Slice CT in eigens unter wissenschaftlichem Standard durchgeführten Messungen nachgewiesen werden. Dabei lag das SULD-Preset in der resultierenden effektiven Dosis gegenüber dem Projektionsröntgen in 2 Ebenen im Durchschnitt um 23,73 % geringer, im Vergleich zu dem Multi Slice CT im Durchschnitt um 93,7 % geringer.
Die aufgezeigten Fallbeispiele aus dem Praxisalltag zeigen exemplarisch, dass das MRT häufig nicht allein die vorliegenden Fragestellungen ausreichend beantworten kann und eine ergänzende Aufnahme mit einem DVT sinnvoll ist. Da die Projektionsradiographie in 2 Ebenen häufig keine ausreichende Bildinformation ermöglicht, würde deren Einsatz als Primärdiagnostik vor der Durchführung einer DVT-Aufnahme unter Anwendung des SULD-Preset anhand der aufgezeigten Ergebnisse die Dosis des Patienten nahezu verdoppeln. Auf Basis dieser Betrachtung ist die DVT mit verfügbarem SULD-Preset als Primärdiagnostik zur Erfüllung des im Strahlenschutz vorgeschriebenen ALARA-Prinzip der Projektionsradiographie vorzuziehen und der Einsatz der MSCT in Bereichen, die mit der digitalen Volumentomographie abgedeckt werden können, obsolet.
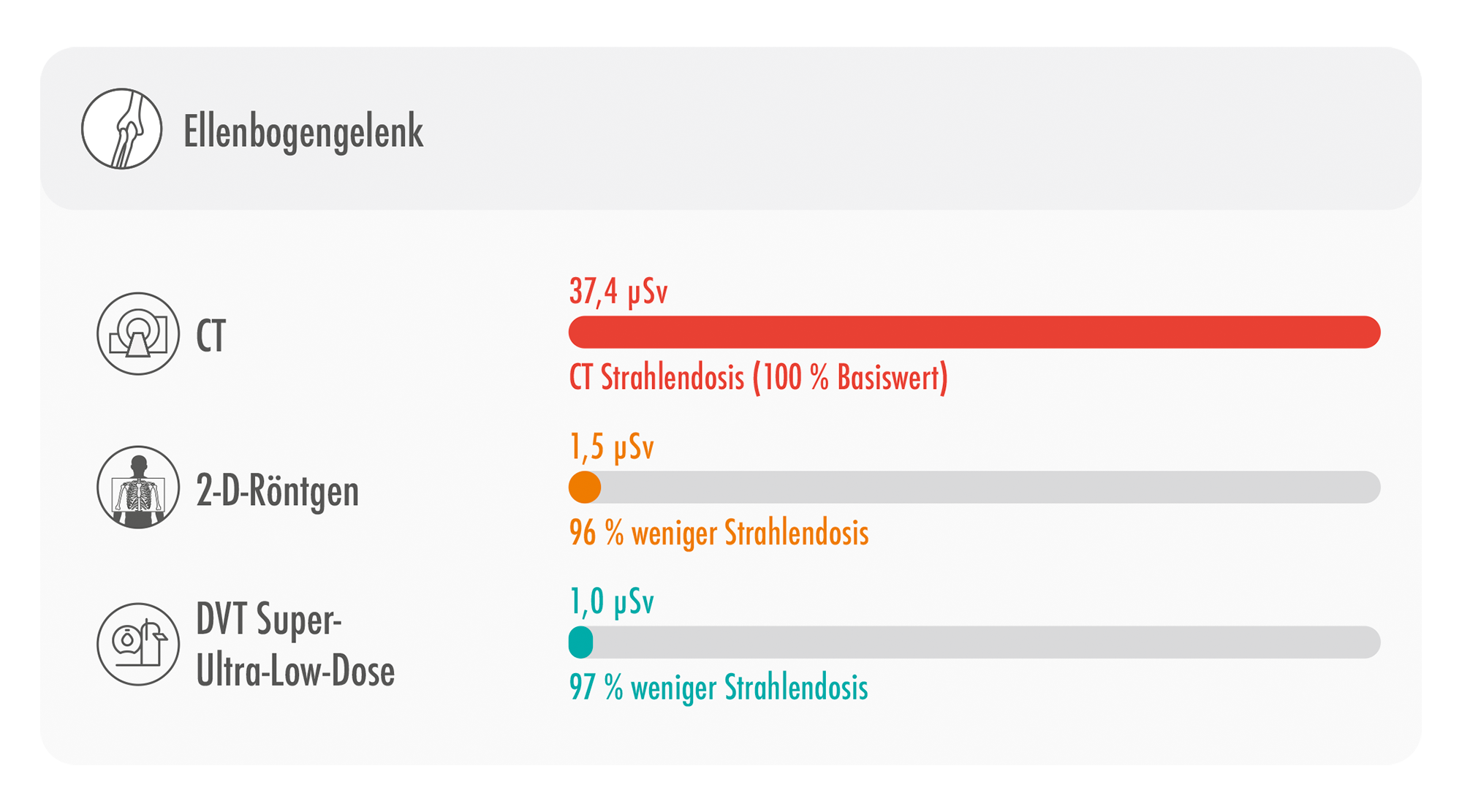 Abb. 5: Darstellung der resultierenden effektiven Strahlendosis eines MSCT, eines Projektionsröntgen in 2 Ebenen sowie eines DVT unter Anwendung des SULD-Preset im Bereich des Ellenbogens [8]
Abb. 5: Darstellung der resultierenden effektiven Strahlendosis eines MSCT, eines Projektionsröntgen in 2 Ebenen sowie eines DVT unter Anwendung des SULD-Preset im Bereich des Ellenbogens [8]
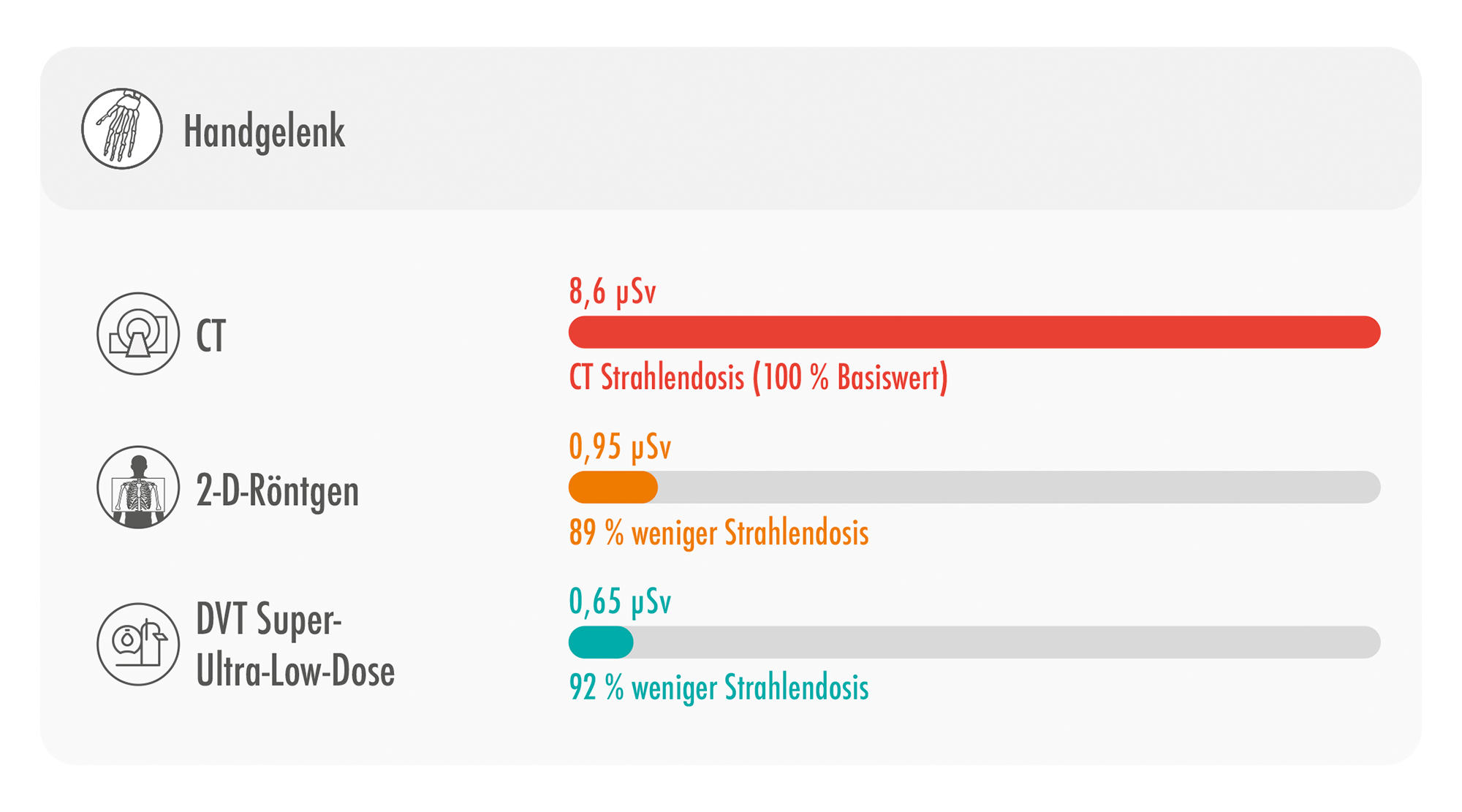 Abb. 6: Darstellung der resultierenden effektiven Strahlendosis eines MSCT, eines Projektionsröntgen in 2 Ebenen sowie eines DVT unter Anwendung des SULD-Preset im Bereich des Handgelenks [9]
Abb. 6: Darstellung der resultierenden effektiven Strahlendosis eines MSCT, eines Projektionsröntgen in 2 Ebenen sowie eines DVT unter Anwendung des SULD-Preset im Bereich des Handgelenks [9]
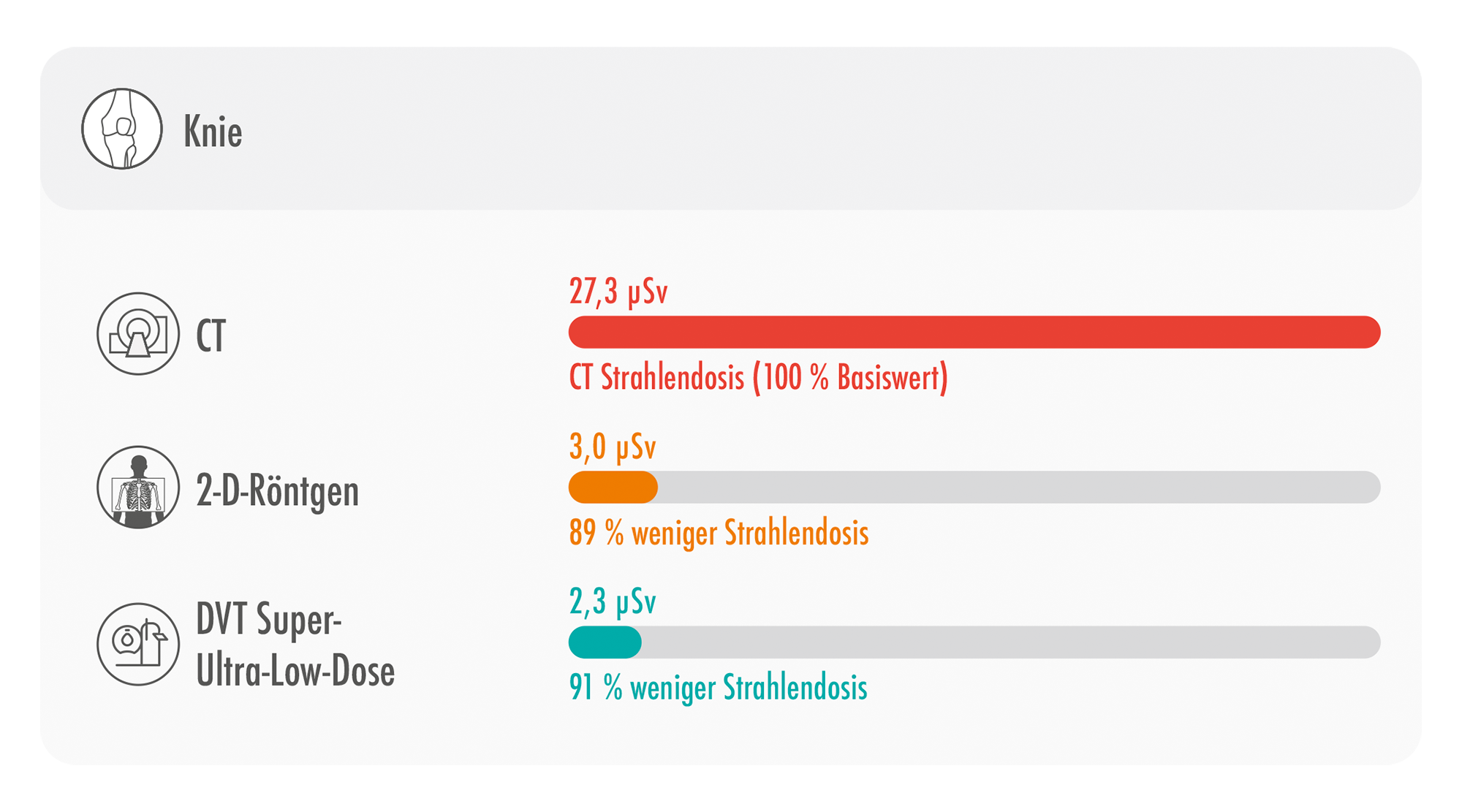 Abb. 7: Darstellung der resultierenden effektiven Strahlendosis eines MSCT, eines Projektionsröntgen in 2 Ebenen sowie eines DVT unter Anwendung des SULD-Preset im Bereich des Kniegelenks [10]
Abb. 7: Darstellung der resultierenden effektiven Strahlendosis eines MSCT, eines Projektionsröntgen in 2 Ebenen sowie eines DVT unter Anwendung des SULD-Preset im Bereich des Kniegelenks [10]
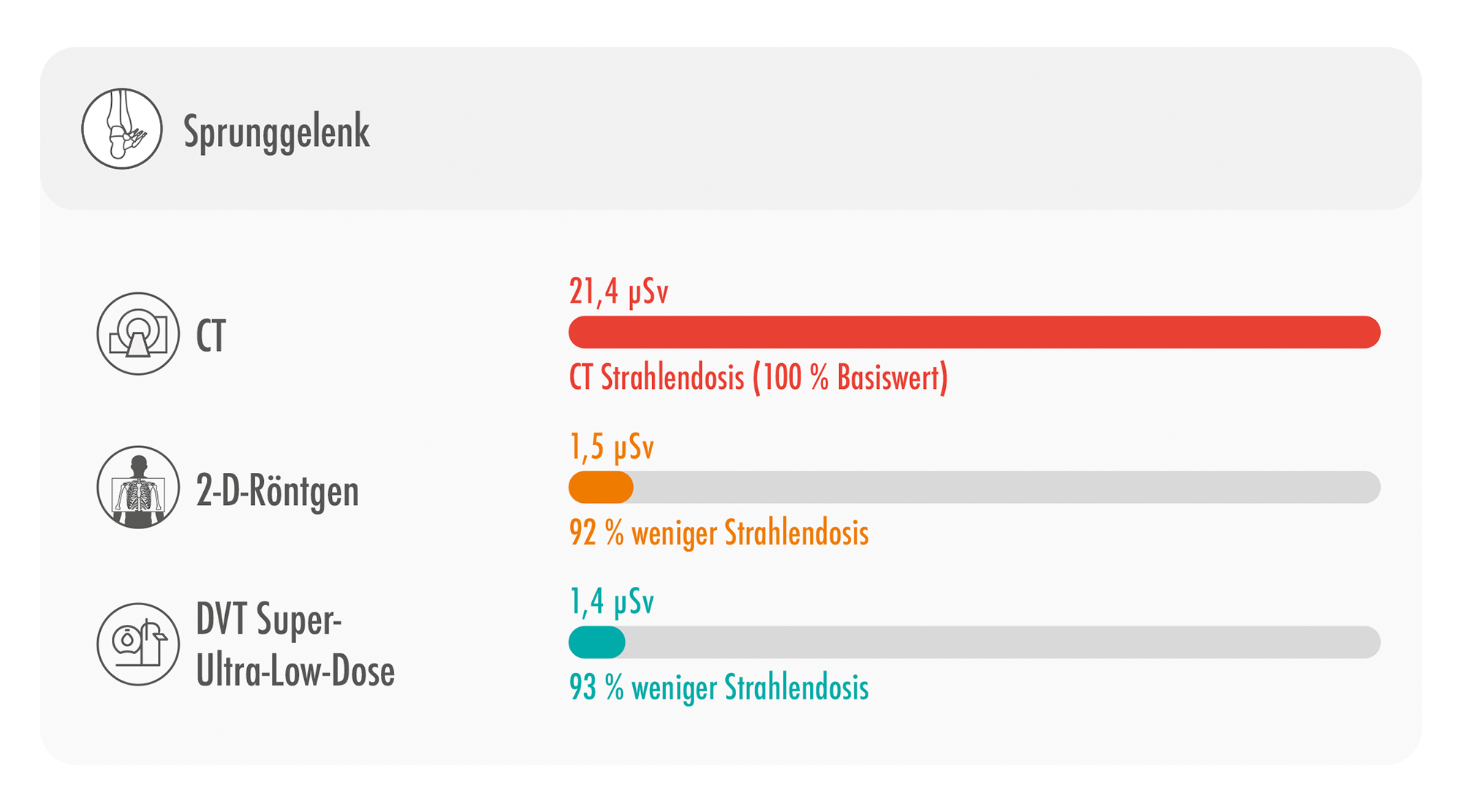 Abb. 8: Darstellung der resultierenden effektiven Strahlendosis eines MSCT, eines Projektionsröntgen in 2 Ebenen sowie eines DVT unter Anwendung des SULD-Preset im Bereich des Sprunggelenks [11]
Abb. 8: Darstellung der resultierenden effektiven Strahlendosis eines MSCT, eines Projektionsröntgen in 2 Ebenen sowie eines DVT unter Anwendung des SULD-Preset im Bereich des Sprunggelenks [11]
Korrespondierender Autor:
Adj. Prof., PhD. Juha Koivisto
Department of Physics
University of Helsinki
Finnland
Fallbeispiele:
Dr. med. Michael Glatzel M. Sc.
Dr. Glatzel Ganzheitliche Orthopädie
Darmstädter Straße 17
6425 Bensheim
Alle CBCT- bzw. DVT-Aufnahmen wurden mit dem Gerät SCS MedSeries® H22 aufgenommen.
Literatur
[1] Breederveld, R. S., & Tuinebreijer, W. E. (2004). Investigation of computed tomographic scan concurrent criterion validity in doubtful scaphoid fracture of the wrist. Journal of Trauma and Acute Care Surgery, 57(4), 851-854. doi: 10.1097/01.TA.0000124278.29127.42.
[2] Cruickshank, J., Meakin, A., Breadmore, R., Mitchell, D., Pincus, S., Hughes, T., Bently, B., Harris, M. and Vo, A. (2007), Early computerized tomography accurately determines the presence or absence of scaphoid and other fractures. Emergency Medicine Australasia, 19: 223-228. https://doi.org/10.1111/j.1742-6723.2007.00959.x.
[3] Collan, L, Kankare, JA, Mattila, K. (2013), The biomechanics of the first metatarsal bone in hallux valgus: A preliminary study utilizing a weight bearing extremity CT. Foot Ankle Surg. 19(3), 155-161 http://dx.doi.org/10.1016/j.fas.2013.01.003.
[4] Salo, J., Töyräs, J., Joukainen, A., Jurvelin, J., Kröger, H (2013). Rustovaurioiden kehittyvä diagnostiikka – nopein hoitotuloksia parantava tekijä? Suomen Ortopedia ja Traumatologia Vol. 36, 256-261.
[5] Colin, F., Horn Lang, T., Zwicky, L., Hintermann, B., & Knupp, M. (2014). Subtalar joint configuration on weightbearing CT scan. Foot & ankle international, 35(10), 1057-1062
doi: 10.1177/1071100714540890.
[6] Huang, A. J., Chang, C. Y., Thomas, B. J., MacMahon, P. J., & Palmer, W. E. (2015). Using cone-beam CT as a low-dose 3D imaging technique for the extremities: initial experience in 50 subjects. Skeletal radiology, 44(6), 797-809. https://doi.org/10.1007/s00256-015-2105-9.
[7] Neubauer, J., Benndorf, M., Ehritt-Braun, C., Reising, K., Yilmaz, T., Klein, C., … & Goerke, S. M. (2018). Comparison of the diagnostic accuracy of cone beam computed tomography and radiography for scaphoid fractures. Scientific reports, 8(1), 1-6 https://doi.org/10.1038/s41598-018-22331-8.
Die effektiven Dosen dieser Studie wurden auf der Grundlage früherer Studien zur Dosisbewertung berechnet:
[8] Koivisto, J., van Eijnatten, M., Ludlow, J., Kiljunen, T., Shi, X. Q., & Wolff, J. (2021). Comparative dosimetry of radiography device, MSCT device and two CBCT devices in the elbow region. Journal of applied clinical medical physics, 22(5), 128-138.
[9] Koivisto, J., Van Eijnatten, M., Kiljunen, T., Shi, X. Q., & Wolff, J. (2018). Effective radiation dose in the wrist resulting from a radiographic device, two CBCT devices and one MSCT device: a comparative study. Radiation protection dosimetry, 179(1), 58-68.
[10] Koivisto, J., Kiljunen, T., Wolff, J., & Kortesniemi, M. (2013). Assessment of effective radiation dose of an extremity CBCT, MSCT and conventional X ray for knee area using MOSFET dosemeters. Radiation protection dosimetry, 157(4), 515-524.
[11] Koivisto, J., Kiljunen, T., Kadesjö, N., Shi, X. Q., & Wolff, J. (2015). Effective radiation dose of a MSCT, two CBCT and one conventional radiography device in the ankle region. Journal of foot and ankle research, 8(1), 1-11.