Arthrose – Schwerpunkt Hüfte und Knie
Ein Artikel von Prof. Dr. med. Götz Welsch I Hamburg
Degenerative Knorpelveränderungen und die daraus entstehende Arthrose haben in den letzten Jahrzehnten an Häufigkeit zugenommen. Schätzungen gehen von weltweit über 250 Millionen betroffenen Patienten/-innen aus (Hunter and Bierma-Zeinstra 2019). Für die betroffenen Patienten/-innen entstehen neben Gelenkschmerzen und Funktionseinschränkungen auch eine Abnahme der Leistungsfähigkeit und somit ein Verlust von Lebensqualität (Watt et al. 2019). Bei der Arthrose handelt es sich um ein komplexes Syndrom, welches neben den direkten Gelenkstrukturen, wie hyalinem Gelenkknorpel und subchondralem Knochen, auch die angrenzenden Strukturen, wie Ligamente und Bänder, Synovialmembran und die angrenzende Muskulatur, umfasst (Hunter and Bierma-Zeinstra 2019).
Noch vor dem Hüftgelenk ist das Kniegelenk am häufigsten von degenerativen Knorpelveränderungen und Arthrose betroffen. Hauptrisikofaktoren zur Entwicklung einer degenerativen Knorpelveränderung des Knie- oder Hüftgelenkes sind mittleres bis fortgeschrittenes Alter, weibliches Geschlecht, Übergewicht, anatomische Fehlstellungen und Verletzungen des Gelenkes (Silverwood et al. 2015).
Bei der Entstehung wird in primäre und sekundäre Arthrose unterschieden. Die primäre Arthrose wird vor allem von proinflammatorischen Zytokinen, die eine Entzündung und Degeneration von Knorpelgewebe und Synovialmembran hervorrufen, ausgelöst. Bei der sekundären Arthrose steht die mechanische Fehlbelastung, ausgelöst durch eine Verletzung der Gelenkfläche, Überbelastung oder eine Achsfehlstellung, im Vordergrund (Castillo, Sepulveda, and Micheo 2019).
Konservative Therapie
Das Hauptsymptom des Patienten/-in ist der Gelenkschmerz, vergesellschaftet mit weiteren Symptomen wie Gelenkerguss, Bewegungseinschränkung und gestörter neuromuskulärer Ansteuerung. Dies führt sehr häufig in eine Art Teufelskreislauf, in dem der Patient/-innen die schmerzverursachende Bewegung und Aktivität reduziert, mit dem kurzfristigen Erfolg der Schmerzreduktion. Mittel- und langfristig wird durch die reduzierte Bewegung jedoch die muskuläre Ansteuerung des Gelenkes schlechter, ebenso kann eine Gewichtszunahme resultieren. So schreitet die Arthrose fort bei zunehmenden Schmerzen und weiterer Bewegungseinschränkung. Diesen Kreislauf gilt es durch unsere Therapie zu durchbrechen. Schmerzfreiheit, respektive Schmerzarmut und gesteigerte Aktivität sollten das Ziel sein.
Laut Leitlinie sollten bei Knorpelveränderungen des Knie- und Hüftgelenkes immer die Möglichkeiten der konservativen Behandlungsoptionen geprüft und ausgeschöpft werden, bevor man operative Intervention in Betracht zieht (Skou and Roos 2019). Diese Prämisse sollte man im Sinne der Patient/-innen ernst nehmen, da man als Orthopäde zu häufig nur die operativen Therapiemöglichkeiten im Blick hat, man damit aber häufig den zweiten (oder dritten) Schritt vor dem ersten geht.
Dieser erste Schritt sollte individuell auf den Patienten/-in abgestimmt sein und folgende Faktoren zur Auswahl der Therapieverfahren sollten berücksichtig werden (Bork and Gottfried 2020):
- Ursache und Lokalisation der Knorpelschädigung
- Schweregrad und Symptomatik
- Begleiterkrankungen / gesundheitlicher Allgemeinzustand
- Individueller Leidensdruck / Lebensqualität
- Berufliche Situation sowie Erwartungshaltung
Die Ziele der konservativen Behandlung umfassen Schmerzreduzierung, Verbesserung der Beweglichkeit und Muskelkraft, Steigerung der Ausdauer, Verlangsamung des Fortschreitens der Erkrankung und damit langfristig eine Verbesserung der Lebensqualität (Fransen et al. 2015; Ayhan, Kesmezacar, and Akgun 2014).
Bestandteile dieser konservativen Arthrose Therapie im Knie- und Hüftgelenk sind:
- Lebensstilintervention mit Optimierung der Ernährung, wenn nötig Gewichtsreduktion und Erhöhung der Aktivität.
- Physiotherapie und manuelle Therapie
- Bewegungstherapie und Trainingstherapie
- Einlagenversorgung, ggf. Orthesenversorgung
- Nahrungsergänzungsmittel und Naturstoffe, wenn möglich keine NSARs.
- Injektionstherapie
Im Folgenden möchte ich näher auf die Injektionstherapie des Kniegelenks und der Hüfte insbesondere mit PRP (platelet-rich plasma) eingehen. Jedoch ausdrücklich darauf hinweisen, dass die PRP Injektionstherapie immer als ein Teil einer Kombinationstherapie angesehen werden sollte und es aus meiner Erfahrung wenig Sinn macht sie als Monotherapie anzuwenden, ohne auf die anderen der o.g. Bestandteile einer konservativen Behandlung einzugehen.
Injektionstherapie mittels ACP (Autologes Conditioniertes Plasma)
Degenerative Knorpelveränderungen und die daraus entstehende Arthrose ist eine komplexe Erkrankung, die alle Strukturen eines Gelenkes betreffen kann. Neben der Knorpeldegeneration kommt es zu einer intraartikulären Entzündungsreaktion, welche zu einer Verdickung der Synovialmembran und Degeneration von Menisken und Ligamenten führen kann. Der aus dem Bereich der regenerativen Medizin stammende Therapieansatz der Eigenbluttherapie (PRP) mit plättchenreichem Plasma ist eine Möglichkeit, eine Verbesserung der Symptome zu erreichen in dem versucht wird die intraartikuläre Entzündungsreaktion zu modellieren.
Die Wirkung des PRP im arthrotischen Gelenk ist sehr komplex und beruht auf der Ausschüttung von einer Reihe von Wachstumsfaktoren und Cytokinen aus den Thrombozyten (Ayhan, Kesmezacar, and Akgun 2014). Hierzu gehören unter anderem IGF2, EGF, TGF-1/2 und VEGF, welche nach Injektion in das betroffene Gelenk ihre Wirkung direkt auf die Gelenkfläche und umliegenden Strukturen entfalten können (Billesberger et al. 2020; Ayhan, Kesmezacar, and Akgun 2014). Diese Wachstumsfaktoren fördern im behandelten Gelenk unter anderem die Chondrogenese, Zelldifferenzierung, Knochenumbau und Angiogenese. Des Weiteren kommt es zu einer Hemmung von intraartikulären Entzündungsprozessen und Apoptose von Chondrozyten (Bennell, Hunter, and Paterson 2017). In vielen Studien konnte ein positiver Effekt nach der Behandlung mit PRP bei Patienten/-innen mit degenerativen Knorpelveränderungen gezeigt werden. Die Patienten/-innen hatten nach Behandlung weniger Schmerzen und konnten die Beweglichkeit des betroffenen Gelenkes verbessern. Dieser Effekt konnte während der Studienzeit von 24 Wochen und darüber hinaus beobachtet werden (Cerza et al. 2012). Des Weiteren konnte gezeigt werden, dass bei der i.a.-Injektionstherapie mit PRP keine unerwünschten Nebenwirkungen auftraten (Smith 2016).
Anwendung von ACP im Kniegelenk
Degenerative Knorpelveränderungen im Kniegelenk sind äußerst häufig und die Durchführung der Injektion ist relativ einfach. Somit hat sich in den letzten Jahren das Kniegelenk als das mit weitem Abstand am häufigsten mittels PRP behandelte Gelenk herausgestellt mit der entsprechend besten Studienlage. So zeigen große Metaanalysen bei über 800 mit PRP behandelten Patienten/-innen eine signifikante Verbesserung z.B. des WOMAC Scores von 45% durchschnittlich 12 Monate nach Injektion (Belk et al. 2021). Zusätzlich zeigte Leukozyten-armes PRP einen signifikant besseren IKDC Score als Leukozyten-reiches PRP (p<0.05). Möglicherweise erhöht Leukozyten-reiches PRP eine Entzündungsreaktion und verzögert hierdurch den Heilungsprozess (Belk et al. 2021). Bei dem Produkt ACP handelt es sich um ein Leukozyten-armes PRP.
Im Vergleich zu ACP zeigt die Studienlage auch positive Ergebnisse bezüglich der Anwendung von Hyaluron im Kniegelenk mit durchschnittlich etwas früherem Wirkungseintritt, dafür aber etwas schlechteren Ergebnissen was den mittel- und langfristigen Erfolg betrifft (Belk et al. 2021; Cerza at al. 2012). Interessant ist eine Kombinationstherapie beider Produkte. Hier zeigt sich die Kombination aus PRP und Hyaluron jeweils etwas besser als PRP alleine (Zao et al. 2020) respektive Hyaluron alleine (Karasavvidis et al. 2021). Ähnlich wichtig wie der therapeutische Erfolg ist die Tatsache, dass sich in Bezug auf mögliche unerwünschte Nebenwirkungen kein signifikanter Unterschied zwischen der Kombination von PRP mit Hyaluron als bei der alleinigen Gabe von PRP oder Hyaluron zeigte (Zao et al. 2020 und Karasavvidis et al. 2021).
Eigene Erfahrungen
Grundsätzlich wende ich wie oben beschrieben ACP immer im Rahmen einer multimodalen konservativen Therapie an. Hier ist der erste Punkt die Reduktion des Schmerzes und somit der Entzündung des Gelenkes. Dies ist unabdingbar, um weitere Schritte einleiten zu können mit dem Ziel (wie oben beschrieben) den Schmerz zu reduzieren und die Aktivität der Patienten/-innen zu erhöhen. Da ein möglichst langanhaltender Therapieerfolg wünschenswert ist, führe ich immer mindestens 3 ACP Injektionen in wöchentlichem Abstand durch.
Des Weiteren erfolgt, wenn möglich eine zeitgleiche multi-modale Therapie, um den Behandlungserfolg mit ACP zu unterstützen. Diese beinhaltet:
- Supplementation von entzündungshemmenden und die Gelenkhomöostase optimierenden Nahrungsergänzungsmitteln (NEM) und Pflanzenstoffen
- Ernährungsoptimierung und Gewichtsreduktion (wenn nötig)
- Physiotherapie
- Aufbau von Tiefenstabilität (vor allem Rumpf)
- Keine zusätzliche körperliche Belastung (zum täglich normalen Umfang) in der Zeit der Injektionen
- Kein Sport mit Stop-and-go oder Zweikämpfe für mindestens 6 Wochen und bis zur deutlichen Reduktion von Schmerz und Entzündungszustand des Gelenkes
- Einlagenanpassung (wenn sinnvoll) und Ganganalyse
Additiv kombiniere ich gerade bei schwereren Gelenkschädigungen und insbesondere wenn auch eine ossäre Komponente (z.B. ein ausgeprägtes Knochenmarködem) vorliegt (und gleichzeitig kein größerer Erguss besteht) meine ACP Therapie mit der Injektion von Hyaluron. Bei jüngeren Patienten/-innen, bei geringer gradigen chondralen Schäden und bei Patienten/-innen mit deutlicher Ergussbildung führe ich keine Kombinationstherapie durch, sondern eine alleinige 3 bis 5-malige ACP Injektion. Bei bestehender deutlicher Ergussbildung erfolgt erst eine sonographisch gesteuerte Ab-Punktion des Ergusses und dann die ACP Injektion gefolgt von Kompression (gerne kompletter Kompressionsstrumpf).
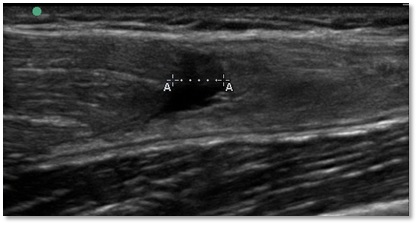
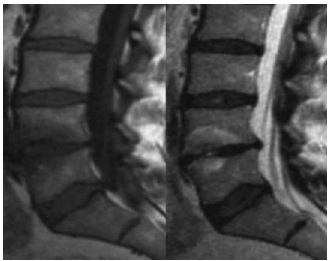
Abbildung 1: 52-jähriger Patient mit einer Knorpelläsion der Trochlea. Der Patient ist sportlich noch sehr aktiv, spielt regelmäßig Tennis und hat bei der typischen Stop-and-go Belastung stechende Schmerzen im Kniegelenk. Konservatives Vorgehen mit 3-maliger ACP Injektion.
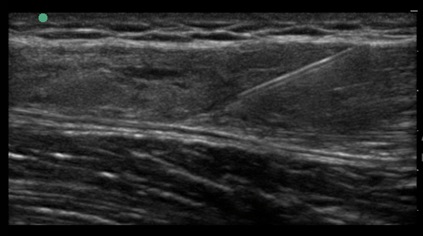
Abbildung 2: 47-jährige Patientin bei Z.n. VKB-Plastik vor 20 Jahren und rezidivierenden Schmerzen bei Belastung. Konservatives Vorgehen seitens der Patientin erwünscht. Die Patientin kommt seit 4 Jahren zur jährlichen ACP Injektion (jeweils 3 Injektionen). Unter diesem Vorgehen konnte der Status des Gelenkes erhalten werden.
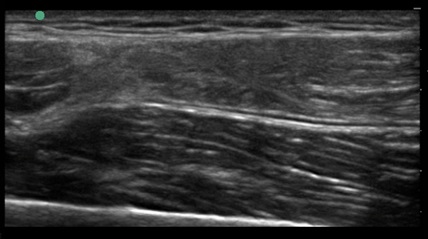
Abbildung 3: 71-jährige übergewichtige Patientin mit massiven Schmerzen im Bereich des medialen Kompartimentes. Multimodale Behandlung mit: 3-maliger Injektion von ACP und Hyaluron, Orthese, Osteologischer Behandlung, Physiotherapie, Lebensstilintervention (Ernährung, Gewichtsreduktion) und antiinflammatorischen NEMs.
Anwendung von ACP im Hüftgelenk
Wie bei den anderen großen Gelenken der unteren Extremität auch, können an der Hüfte chondrale und osteochondrale Läsionen durch akut-traumatische, chronische oder degenerative Veränderungen entstehen. Die Inzidenz der akut-traumatischen Knorpelläsionen ist dabei vergleichsweise gering. Es gibt jedoch Evidenz darüber, dass neben der residualen Hüftdysplasie als präarthrotische Deformität, auch das femoroacetabuläre Impingement (FAI) als eine weitere Hauptursache der Coxarthrose anzusehen ist. Hier entsteht zunächst eine lokalisierte Schädigung des Gelenkknorpels welche im Verlauf zur sekundären Koxarthrose führen kann (Murphy et al. 2016). Im Vergleich zum Kniegelenk hinkte die Hüfte bei allen konservativen und operativen gelenkerhaltenden Therapieformen lange hinterher. In den letzten Jahren wird jedoch auch die ACP Therapie im Hüftgelenk mit zunehmendem Erfolg und in zunehmender Fallzahl durchgeführt. Seitens der Studienlage gibt es zwar weniger Untersuchungen als im Kniegelenk, jedoch zeigt sich auch in der Hüfte eine zunehmend positive Evidenz für die Anwendung von PRP. Eine aktuelle Metanalyse mit 334 Patienten/-innen zeigte eine signifikante Verbesserung der Schmerzscores 3, 6 und 12 Monate nach Injektion (Garcia at al., 2020). Ein Vergleich von PRP und Hyaluron zeigte eine verbesserte Rotation und geringere Schmerzen 6 Monate nach Injektion von PRP, und im längeren Follow-up von 12 und 24 Monaten interessanterweise eine längere Verzögerung einer nötigen Hüft-Endoprothese (Krautler et al. 2021).
Eigene Erfahrungen
Genauso wie im Kniegelenk versuche ich auch im Hüftgelenk die ACP Therapie wenn möglich nicht als alleinige Therapie durchzuführen, sondern im Rahmen einer Kombinationstherapie. Wobei die anderen Bestandteile wie Bewegungstherapie, Physiotherapie, Entzündungshemmung, ggf. Gewichtsreduktion vergleichbar zum Kniegelenk sind. In der Bewegungstherapie und Physiotherapie sollte man aber natürlich spezifisch auf das Hüftgelenk eingehen. Hier ist eine Mitbehandlung der Lendenwirbelsäule und des Iliosakralgelenkes noch essenzieller als im Bereich des Kniegelenkes. Eine Steigerung des Bewegungsausmaßes im Hüftgelenk sollte zudem nicht zu aggressiv durchgeführt werden. Dennoch verbleibt es in jedem Fall ein Ziel der Therapie die gesamte Beweglichkeit im Bereich der Hüfte zu erhöhen.
Im Hüftgelenk führe ich klassischerweise 3 ACP Injektionen in wöchentlichem Abstand durch. Die Rolle der ultraschall-unterstützten Injektion spielt hier eine deutlich größere Rolle als im Kniegelenk. So führe ich in der Hüfte alle Injektionen unter sonographischer Kontrolle durch. Ich injiziere das Hüftgelenk hierbei von ventral. Natürlich unter streng sterilen Kautelen und nach entsprechender Aufklärung der Patienten/-innen. Die praktische Durchführung der ACP Injektion der Hüfte ist nach einer kurzen Anlaufphase aber ähnlich einfach und schnell wie im Kniegelenk und wird von den Patienten/-innen sehr gut toleriert.
In den Letzten Jahren ist die Anzahl der mit ACP in der Hüfte behandelten Patienten/-innen deutlich gestiegen und deren Zufriedenheit ist sehr hoch. Durch das gegebene Volumen zeigt sich sogar relativ häufig eine sofortige Schmerzreduktion. Additiv kann man auch im Bereich des Hüftgelenkes eine Kombinationstherapie von ACP und Hyaluron durchführen.
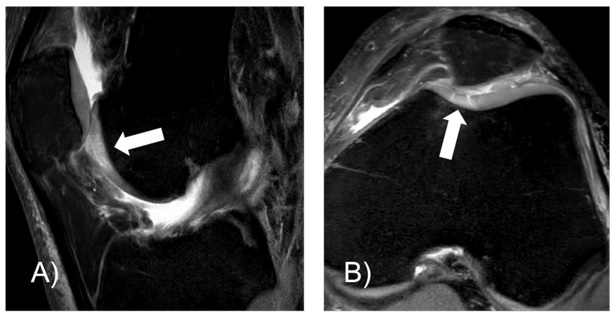
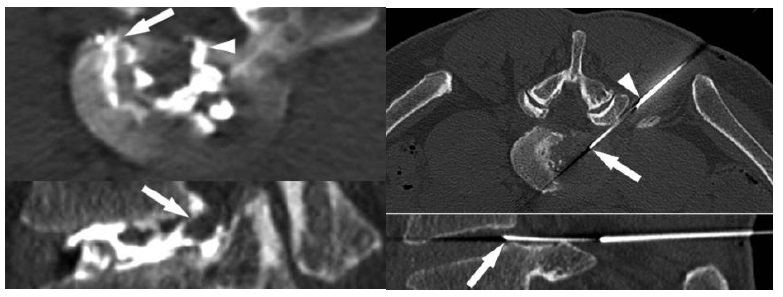
Abbildung 4.: 65-jähriger Patient mit deutlichem femuro-acetabulärem Impingement der rechten Hüfte. Bestehender Zyste im Acetabulum mit angrenzender Destruktion des Acetabulärem Labrums und vor allem acetabulärem Knorpelschaden (Pfeile). Der Patient zeigt auch klinisch typische Arthrosezeichen mit deutlich eingeschränkter und schmerzhafter Innenrotation, Anlaufschmerz, und belastungsabhängigen Schmerzen. Der Patient spielt Golf was ihm nicht mehr möglich ist. Konservatives Vorgehen mit 3-maliger ACP Injektion.
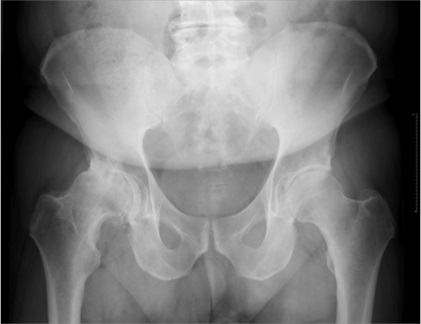
Abbildung 5.: Röntgen Hüfte: Bei diesem Patienten mit endgradiger Arthrose im rechten Hüftgelenk und weitgehend aufgehobenen Gelenkspalt macht z.B. aus meiner Sicht eine Injektionstherapie keinen Sinn mehr.
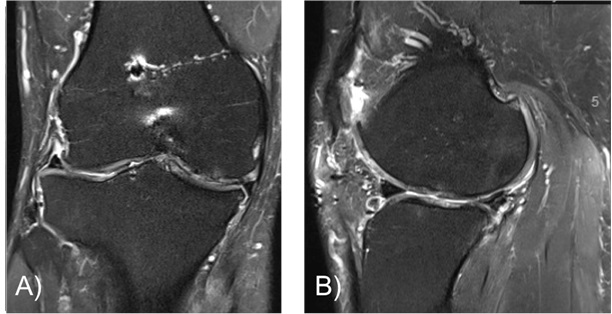
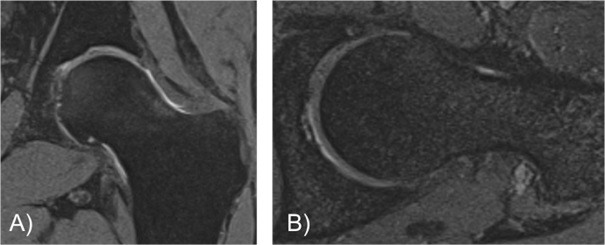
Abbildung 6.: 56-jährige Patientin mit Knorpelveränderungen der acetabulären Belastungszone. Sie berichtet über rezidivierende, belastungsabhängige Schmerzen in der linken Hüfte. Obwohl man im MRT keine fortgeschrittene Arthrose sieht, ist gerade für Patienten/-innen mit weniger stark ausgeprägten Arthrosezeichen, aber hohem Leidensdruck eine Eigenblutinjektion häufige eine sinnvolle Therapie.
Zusammenfassung:
Knorpelveränderungen und eine folgende Arthrose im Knie- und Hüftgelenk sind extrem häufig. Betroffene Patienten/-innen sind zunehmend inaktiv, haben Schmerzen und eine teilweise ausgeprägte Einschränkung der Lebensqualität. Für symptomatische Patienten/-innen mit leichter und mittelschwerer Arthrose ist die Eigenbluttherapie eine sehr gute Option in der konservativen Behandlung des betroffenen Gelenkes. Im Kniegelenk und zunehmend auch im Hüftgelenk zeigt eine zunehmende Anzahl von Studien und Metaanalysen den Evidenz-basierten Erfolg dieser Behandlungsoption. Zudem ist bei entsprechend steriler Anwendung das Nebenwirkungsprofil dieser Therapieform extrem gering. Ich selbst erzielte mittlerweile seit etwa 15 Jahren verlässlich guter Erfolge mit ACP Injektionen.
Prof. Dr. med. Götz Welsch
Ambulanzzentrum des UKE GmbH
UKE Athleticum
Hamburg
__________________________________________________________________________
Literatur:
Ayhan, E., H. Kesmezacar, and I. Akgun. 2014. ‘Intraarticular injections (corticosteroid, hyaluronic acid, platelet rich plasma) for the knee osteoarthritis’, World J Orthop, 5: 351-61.
Belk, J.W. et al.: Platelet-Rich Plasma Versus Hyaluronic Acid for Knee Osteoarthritis: A Systematic Review and Meta-analysis of Randomized Controlled Trials. Am Journal of Sports Medicine 2021.
Bennell, K. L., D. J. Hunter, and K. L. Paterson. 2017. ‘Platelet-Rich Plasma for the Management of Hip and Knee Osteoarthritis’, Curr Rheumatol Rep, 19: 24.
Billesberger, L. M., K. M. Fisher, Y. J. Qadri, and R. L. Boortz-Marx. 2020. ‘Procedural Treatments for Knee Osteoarthritis: A Review of Current Injectable Therapies’, Pain Res Manag, 2020: 3873098.
Bochdansky, Thomas, and Kurt Ammer. 2006. ‘Trainingstherapie bei rheumatischen Erkrankungen’, Grundlagen und praktische Empfehlungen zur Sportausübung. ÖZPMR: Österr Z Phys Med Rehabil, 16: 15-27.
Bork, Hartmut, and Thomas Gottfried. 2020. ‘Konservative Therapie der Arthrose unter Berücksichtigung der Physikalischen Therapie’, Akt Rheumatol, 45: 59-66.
Castillo, B., F. Sepulveda, and W. Micheo. 2019. ‘Conservative Management and Rehabilitation in the Older Runner With Knee Osteoarthritis: An Evidence-Based Review’, Am J Phys Med Rehabil, 98: 416-21.
Cerza, F., S. Carnì, A. Carcangiu, I. Di Vavo, V. Schiavilla, A. Pecora, G. De Biasi, and M. Ciuffreda. 2012. ‘Comparison between hyaluronic acid and platelet-rich plasma, intra-articular infiltration in the treatment of gonarthrosis’, Am J Sports Med, 40: 2822-7.
Fransen, M., S. McConnell, A. R. Harmer, M. Van der Esch, M. Simic, and K. L. Bennell. 2015. ‘Exercise for osteoarthritis of the knee: a Cochrane systematic review’, Br J Sports Med, 49: 1554-7. 18
F.L. Garcia et al.: Preparation Methods and Clinical Outcomes of PRP for Intra-articular Hip Disorder. OJSM. 2020.
Hunter, D. J., and S. Bierma-Zeinstra. 2019. ‘Osteoarthritis’, Lancet, 393: 1745-59.
- Karasavvidis et al.: Platelet-Rich Plasma Combined With Hyaluronic Acid Improves Pain and Function Compared With Hyaluronic Acid Alone in Knee Osteoarthritis: A Systematic Review and Meta-analysis. Arthroscopy 2021.
Krauetler M.J., Houck D.A., Garabekyan T., Miller S.L., Dragoo J.L., Mei-Dan O.: Intra-articula injections of Leukocyte Poor PRP sersus Low-Molecular weighted HA in the treatment of HIP OA. OJSM 2021
Murphy NJ, Eyles JP, Hunter DJ. Hip osteoarthritis: Etiopathogenesis and implication for management. Adv Ther 2016(33): 1921-1946.
Silverwood, V., M. Blagojevic-Bucknall, C. Jinks, J. L. Jordan, J. Protheroe, and K. P. Jordan. 2015. ‘Current evidence on risk factors for knee osteoarthritis in older adults: a systematic review and meta-analysis’, Osteoarthritis Cartilage, 23: 507-15.
Skou, S. T., and E. M. Roos. 2019. ‘Physical therapy for patients with knee and hip osteoarthritis: supervised, active treatment is current best practice’, Clin Exp Rheumatol, 37 Suppl 120: 112-17.
Smith, P. A. 2016. ‘Intra-articular Autologous Conditioned Plasma Injections Provide Safe and Efficacious Treatment for Knee Osteoarthritis: An FDA-Sanctioned, Randomized, Double-blind, Placebo-controlled Clinical Trial’, Am J Sports Med, 44: 884-91.
Watt, F. E., N. Corp, S. R. Kingsbury, R. Frobell, M. Englund, D. T. Felson, M. Levesque, S. Majumdar, C. Wilson, D. J. Beard, L. S. Lohmander, V. B. Kraus, F. Roemer, P. G. Conaghan, and D. J. Mason. 2019. ‘Towards prevention of post-traumatic osteoarthritis: report from an international expert working group on considerations for the design and conduct of interventional studies following acute knee injury’, Osteoarthritis Cartilage, 27: 23-33.
Zao, J. et al.: Effects and safety of the combination of platelet-rich plasma (PRP) and hyaluronic acid (HA) in the treatment of knee osteoarthritis: a systematic review and meta-analysis. BMC Musculuskeletal Disorders 2020.