Fragen wir immer erst „warum“?
Die biologisch regenerative Behandlung von vielen Beschwerden des muskuloskelettalen Systems mit Hilfe von autologen, also körpereigenen Stoffen, wird seit geraumer Zeit unter Fachexperten kontrovers diskutiert. In den letzten zehn Jahren haben sich die Publikationen zum Thema „Plättchenreiches Plasma“ (PRP) in der Orthopädie und Sportmedizin mehr als verdoppelt. Die meisten klinischen Publikationen über PRP befassen sich mit der Behandlung verschiedener Stadien der Gonarthrose. Die mit am häufigsten in der sportmedizinischen Praxis vorkommenden Erkrankungen, bei denen PRP regelhaft Verwendung findet, sind die Arthrose, Tendinopathien und Muskelverletzungen.
Gonarthrose
Spätestens seit der Publikation der RESTORE-Studie im hoch angesehenen JAMA 2021, in der gezeigt wurde, dass PRP keinen Benefit im Vergleich zu Placebo-Kochsalzinjektionen in Bezug auf Schmerzen und Knorpeldicke nach 12 Monaten aufwies (1), sind die Stimmen gegen die Anwendung von PRP insbesondere in Europa zunächst lauter geworden. Kontrovers wurde es auch deswegen diskutiert, da vor der RESTORE-Studie bereits einige Hinweise auf einen positiven Effekt von PRP in Meta-Analysen vorlagen (2-6).
Betrachtet man das verwendete PRP-Produkt in der RESTORE-Studie fällt auf, dass es sich um ein „single-spin“ Produkt handelt, welches ca. 10 ml Patientenblut pro Intervention verwendet. Daraus resultiert laut Herstellerangabe eine 1,6- bis 5-fache PRP-Konzentration im Vergleich zum Vollblut. Die Gesamtmenge an Plättchen in 10 ml Blut ist im Verhältnis gering und insgesamt erscheinen die Konzentrationsangaben des Herstellers als breit gestreut und Publikationen legen Zweifel nahe, ob die Herstellung eines Thrombozytenkonzentrats mit dem in dieser Studie verwendeten Produkt zuverlässig möglich ist (7, 8) . Laut Marx et al. (9) wird PRP definiert als 5 ml Blutplasma mit einer Konzentration von 1.000.000 Plättchen / µl. Vor diesem Hintergrund stellt sich für den Anwender natürlich die Frage nach einer wirksamen PRP Dosis bei der Behandlung der Gonarthrose.
In den letzten Jahren sind einige Level-1 randomisiert kontrollierte Studien (RCT) publiziert worden, in denen signifikante Ergebnisse zugunsten der PRP-Therapie bei Gonarthrose aufgezeigt werden konnten (9,10).
Die verwendeten PRP-Protokolle wurden in den beiden oben genannten Studien genau definiert und die jeweils verabreichte PRP-Dosis dokumentiert. Beide Studien benutzten „dual-spin“-Zentrifugationsverfahren mit variierenden Parametern.
Chu et al. verwendeten eine 4,3-fache PRP-Konzentration aus 50 ml Vollblut über drei wöchentliche Injektionen. In dieser Studie konnte ein disease-modifying-Effekt mit verminderter Knorpelausdünnung femorotibial nach fünf Jahren im Vergleich zur Kontrollgruppe gezeigt werden. Zudem konnten WOMAC-Scores, IKDC und VAS im Zeitverlauf ebenfalls Signifikanz erlangen sowie eine reduzierte Konzentration von IL-1ß und TNF-α in der Synovialflüssigkeit gefunden werden.
Bansal et al. verwendeten eine Einmalgabe von definierten 10 Milliarden mit ähnlich positiven Ergebnissen verglichen mit einer Einmalgabe von 4 ml hochmolekularer Hyaluronsäure.
Zusammenfassend ergibt sich im aktuellen Stand der klinischen Untersuchung das Bild, dass Thrombozyten eine unerlässliche aktive Komponente der Behandlung sind und eine Dosis zwischen 2,4 und 10 Milliarden Thrombozyten einen der Hyaluronsäure überlegenen klinischen Effekt erzielen. Die Fragen nach einer Minimaldosis, sowie ob eine die Dosis in Zusammenhang mit der Behandlungshäufigkeit steht, bleiben jedoch zum jetzigen Zeitpunkt offen.
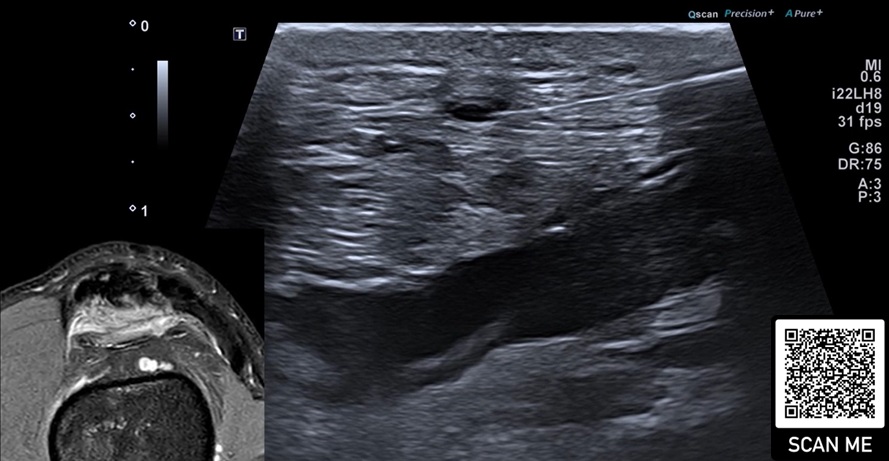
In unserer klinischen Praxis verwenden wir bei Gonarthrosen, je nach Alter und Aktivität sowie Baseline-Plättchenkonzentration entweder eine Ein-bis Zweimalgabe von hochkonzentriertem PRP aus 90 ml Blut/ACD-A und dual-spin-Verfahren (©ACPMax, Arthrex) oder eine Dreimalgabe von Hochvolumen-PRP aus 50 ml Blut/Citrat im single-spin-Verfahren. Alle Infiltrationen an Gelenken erfolgen unter sonographischer Kontrolle gemäß den Empfehlungen der ESSR (11), (Abb.1).
Als generelle Empfehlung kann laut aktueller Datenlage bei jüngeren Patient*innen (<50 Jahre) eine Serie mit drei wöchentlichen PRP-Injektionen mit höherem Volumen erfolgen. Bei älteren Patient*innen kann eine Hochdosis-PRP-Ein- bis Zweimalgabe in Erwägung gezogen werden. Insgesamt sollte eine ausreichend hohe Gesamtdosis pro Gelenk erreicht werden. Dabei helfen die Messung und Dokumentation der Plättchenkonzentration zunächst im Blut vor und anschließend im PRP nach Zentrifugation(en) sowie die Klassifikation der verabreichten PRP-Komposition (12). Da der Aufwand solcher Messungen aktuell in Deutschland nicht flächendeckend umsetzbar erscheint, sollte man zumindest auf hochwertige und effektiv konzentrierende PRP-Verfahren oder hohe Blutentnahme-Volumina setzen. Auf die Sinnhaftigkeit einer höheren PRP-Dosis weist eine aktuelle Studie von Patel et al. hin (13). Eine Serie mit mehr als drei Infiltrationen hat laut aktuellem Wissensstand keine signifikante klinische Besserung zur Folge (14).
Abschließend gilt es zu bemerken, dass obwohl über PRP sehr kontrovers diskutiert wird, es keinerlei Hinweise auf eine schädigende Wirkung auf den Organismus gibt, was bei der sehr weit verbreiteten, von den Kassen bezahlten und in Leitlinien (15) noch verankerten Gabe von intraartikulären Steroiden nicht der Fall ist (16). Noch brisanter sind die Ergebnisse, die eine Korrelation von Steroidinfiltrationen und erhöhtem Risiko für die Notwendigkeit einer Knie-Totalendoprothese im Verlauf sowie eine erhöhte Inzidenz von periprothetischen Infektionen nach Knie-TEP aufzeigen, wenn eine intraartikuläre Steroidgabe innerhalb von drei Monaten präoperativ verabreicht wurde (17,18).
Tendinopathien, Muskel- und Bandverletzungen
Sehnenerkrankungen, Muskel- und Bandverletzungen machen einen sehr großen Anteil der Fälle im Alltag der sportmedizinischen Praxis aus. Unter den am häufigsten eingesetzten invasiven Therapieformen spielt die Verwendung von PRP in den letzten Jahren eine zunehmende Rolle. Vielfach diskutiert wird seit jeher die Gabe von PRP bei akuten Muskelverletzungen. In-vitro- und präklinische Studien bilden eine fundierte Grundlage dafür, dass durch die Gabe von PRP ein positiver Effekt im Heilungsprozess erzeugt werden kann. Nach aktuellem Wissensstand besteht jedoch keine klinisch signifikante Relevanz bei reinen Muskelverletzungen (19,20).
Hingegen gibt es bereits viele Hinweise dafür, dass ein Nebenprodukt bei der Herstellung von PRP, das sog. Plättchenarme Plasma (PPP) bei Muskelverletzungen eine positive regenerative Wirkung haben kann (22).
Dieser Effekt basiert auf einem stimulierenden Einfluss von PPP auf den Signalweg der Myoblasten-Differenzierung, im Kontrast zum proliferierenden Effekt von PRP (23,24).
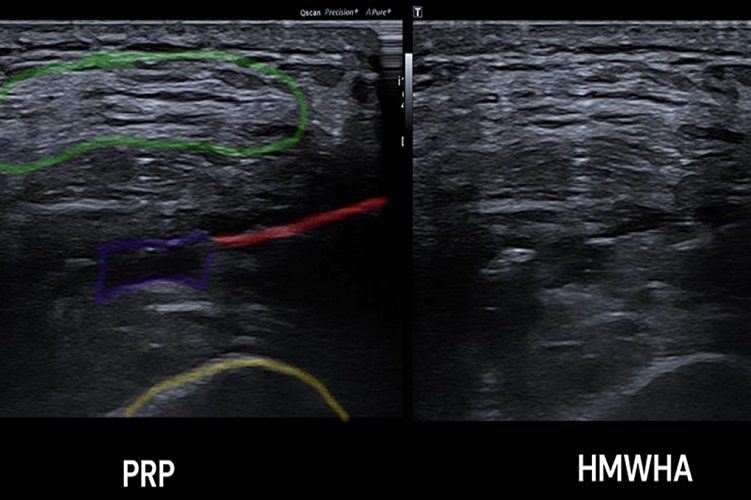
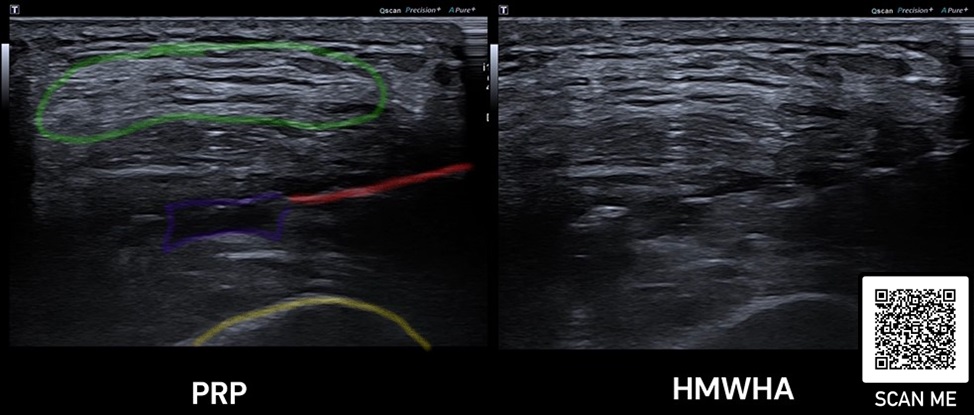
In unserer Institution setzen wir PPP bei reinen Muskelverletzungen insbesondere dann ein, wenn man einen aspirationswürdigen Befund im hochauflösenden Ultraschall findet und eine invasive Maßnahme dadurch empfohlen wird (Abb. 2). Bei myotendinösen Verletzungen setzen wir weiterhin auf Hochdosis-PRP. In der Literatur sind bislang keine spezifischen Behandlungsprotokolle für Muskelverletzungen beschrieben worden. Unsere Infiltrations-Intervalle reichen von einer Einmalgabe in den meisten Fällen bis zweimaliger Gabe innerhalb von zehn Tagen nach Verletzung. Bei verzögerter Heilung oder chronischen Verletzungen, z.B. mit Serom- oder überschießender Narbenbildung, wird ein individueller Behandlungsplan gemeinsam mit dem Athleten geschmiedet.
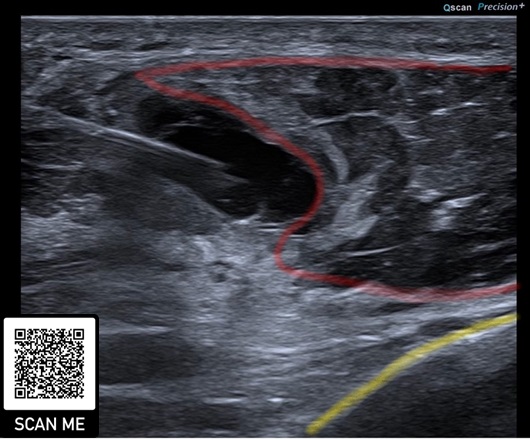
Zunehmend setzen wir mit Erfolg die Ultraschallgestützte Elektrolysetherapie (USGET) allein oder in Kombination mit PRP bei Muskel- und Sehnenverletzungen ein, um einen starken regenerativen Stimulus und eine Gewebe-pH-Veränderung durch den galvanischen Strom am Verletzungsort zu setzen und somit die Rekonvaleszenzzeit zu reduzieren (25,26) (Abb. 3).
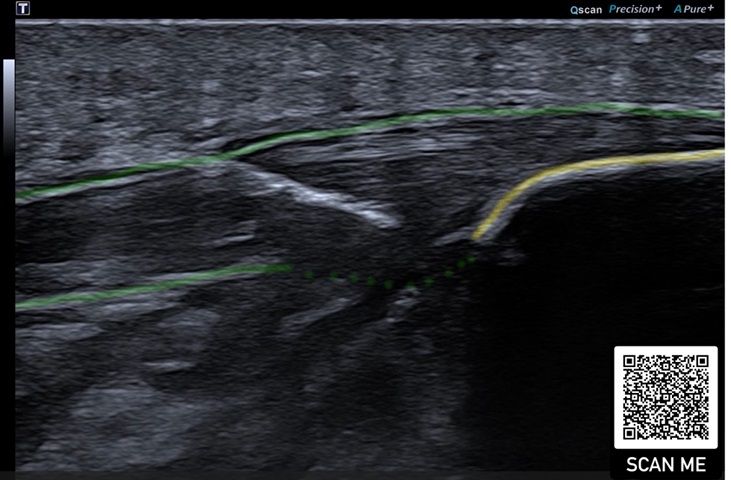
Die Behandlung von Tendinopathien mit PRP ist in der einschlägigen Literatur Gegenstand vieler Diskussionen. Je nach Behandlungsort gibt es unterschiedliche Daten zur Wirksamkeit (27,28). Aufgrund der außerordentlich vielen Faktoren, die die Regeneration, Anpassung und Heilung von Sehnengewebe beeinflussen, kann nicht pauschal über PRP als „gut“ oder „schlecht“ geurteilt werden (29,31).
Auf molekularer Ebene kann PRP viele Mechanismen der Sehnenregeneration positiv beeinflussen. Die große Herausforderung liegt darin, diese Effekte auch in vivo erzielen und dokumentieren zu können (31). Eine im LANCET publizierte Studie an Achillessehnen sechs Wochen nach Ruptur und PRP-Behandlung ergab in Biopsien eine signifikant günstigere Sehnenkonstellation gegenüber Placebo-Kontrollen (32).
Die aktuelle klinische Datenlage ist insbesondere bei Schulter- und Ellenbogenpathologien mehrheitlich positiv. Bei partiellen Rotatorenmanschetten-Läsionen kann eine signifikante Schmerzreduktion und Funktionsverbesserung durch Verwendung von PRP beobachtet werden (33,34).
Wie bereits bei der Kniegelenkarthrose untersucht, kann die Behandlung mit infiltrativen Steroiden langfristig einen schädigenden Effekt auf die Rotatorenmanschette haben (35).
Bei lateraler Epicondylopathie am Ellenbogen konnte der positive Effekt von PRP bislang am deutlichsten beschrieben werden, insbesondere im Langzeit-Vergleich mit Kortikosteroiden (36). Es scheint keine Rolle zu spielen, welche PRP-Zusammensetzung bezogen auf Leukozyten verabreicht wird (37) (Abb. 4).
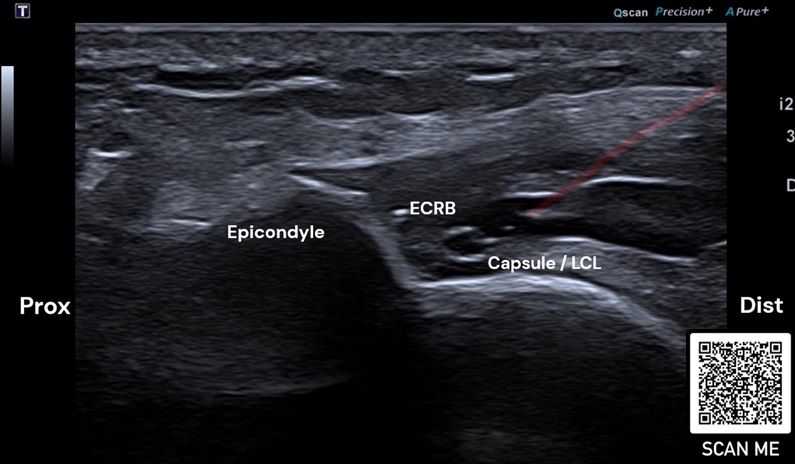
Rot: Nadel
Bei Tendinopathien der unteren Extremität ist die Datenlage heterogen. Aufgrund von unterschiedlichen Behandlungsprotokollen, Infiltrationsart und -ort, Nachbehandlungsschemata sowie PRP-Zusammensetzung, kann keine klare Empfehlung ausgeschrieben werden (37-42).
Einige RCTs beschreiben eine signifikante Verbesserung von Symptomen, Funktion und Struktur, z.B. bei peritrochantären Beschwerden und glutealer Tendinopathie (43,44).
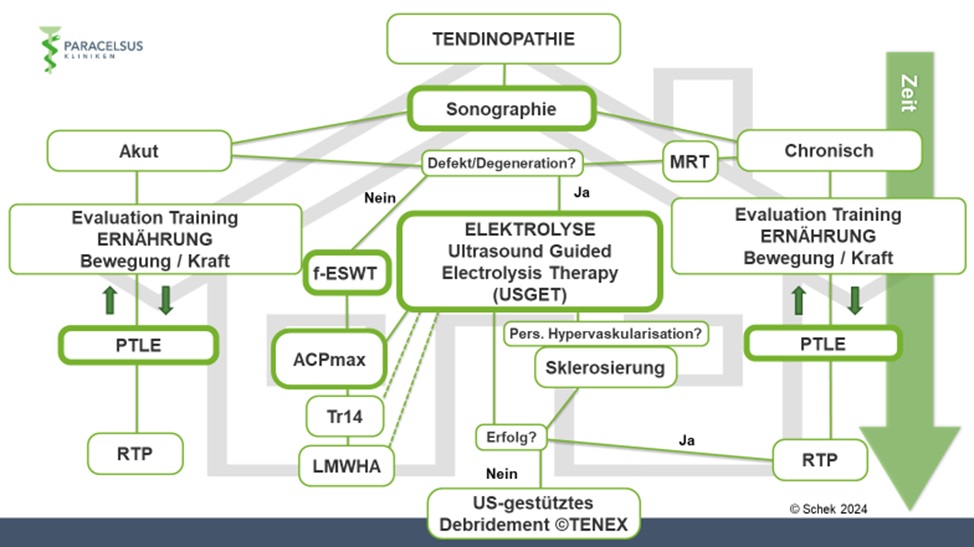
In unserer klinischen Praxis verwenden wir einen Behandlungsalgorithmus basierend auf klinisch-funktionellen und strukturellen Veränderungen (Abb. 5). Unter Einbezug von Sportart, Leistungsniveau, Leidensdruck, Zeitverlauf, Risikokonstellation u.a. gestalten wir die Therapie für die einzelne Person maßgeschneidert. In aller Regel sind nicht-invasive Maßnahmen zentraler Bestandteil der Therapie. Darunter spielen Edukation und „Entkatastrophisierung“, Anpassung der Trainings- und Ernährungsgewohnheiten, gezielte Trainingstherapie mittels PTLE-Programm (Progressive-Tendon-Loading-Exercises) und Stoßwellentherapie (ESWT) eine wichtige Rolle. Dazu setzen wir ergänzend PRP, Ultraschallgestützte Elektrolysetherapie (USGET), Traumeel® (Tr14), Hyaluronsäure und ggf. Sklerosierungstherapie bei entsprechendem Befund regelmäßig ein (Abb. 6). In therapierefraktären Einzelfällen kann ein ultraschallgestütztes Debridement (TENEX®) zusätzlich sinnvoll sein.
Bei der Behandlung von Bandverletzungen gibt es keine klaren Empfehlungen in der Literatur. Aufgrund der theoretischen Grundlage, vieler positiver Case-Series und der nicht-schädigenden Wirkung von PRP, verwenden wir es zudem gerne bei den verschiedensten Bandverletzungen. Hierbei achten wir auch auf eine höhere Konzentration von PRP und verabreichen es in der Regel einmalig und immer unter sonographischer Kontrolle (Abb. 6).
Stellenwert der ultraschallgestützten Therapie
Ein großes Problem bei der genauen Untersuchung von Studienergebnissen in Bezug auf PRP ist, dass ein Großteil der in der Literatur vorkommenden klinischen Studien keine genauen Angaben zur Injektionsart und -ort gemacht werden. Die wenigsten Studien haben ein standardisiertes Injektions-Protokoll angegeben. Somit ist häufig kaum zu eruieren, ob die PRP-Behandlung an Gelenken unter sonographischer Sicht intraartikulär verabreicht wurde oder an Sehnen intra-, peri-, oder als Kombination intra- und peritendinös erfolgte. Es ist mittlerweile erwiesen, dass die Wahrscheinlichkeit einer Fehlinfiltration bei Durchführung ohne Ultraschallunterstützung signifikant höher ist, als mit sonographischer Führung. Dieser Unterschied hat darüber hinaus einen klaren signifikanten Einfluss auf die Wirksamkeit der Therapie (!) (45,46).
Zusammenfassung und Ausblick
Die am häufigsten untersuchte Erkrankung im muskuloskelettalen Bereich in Bezug auf Plättchenreichem Plasma ist die Gonarthrose. Hierbei lässt sich eine klare Tendenz für die Verwendung von PRP und gegen eine unbedachte Anwendung von intraartikulären Steroiden erkennen. Insbesondere in höheren Volumina bzw. Gesamt-Dosis und unter Ultraschallkontrolle wird die PRP-Behandlung in die Werkzeugkiste aller konservativ tätigen Ärztinnen und Ärzte, die nach höchsten Standards Arthrose behandeln, gehören. Wenn es uns gelingt, noch mehr Evidenz für die Behandlung von Muskel-, Sehnen- und Bandverletzungen durch genauere Protokolle, Messung der Dosis und Zusammensetzung des verwendeten Plättchenreichen Plasmas sowie die punktgenaue Applikation durch Ultraschallunterstützung zu generieren, ist das angestrebte Ziel, eine maßgeschneiderte Zusammensetzung des Plasmas für die jeweilige Indikation anbieten zu können.
Je besser wir die pathologischen und regenerativen Prozesse und deren komplexen Zusammenhänge im Körper verstehen, desto eher können wir durch eine Kombinationstherapie z.B. mit PRP und Einsatz unterschiedlicher Therapieansätze wie Elektrolysetherapie (USGET), Stoßwellentherapie, Lasertherapie, Magnetotransduktion, Photobiomodulation und vielen weiteren Methoden, den Entzündungs-Regenerationsprozess so weit modulieren, dass das Gewebe im Sinne eines von Prof. Karsten Knobloch eingeführten Begriffes des „Soft Tissue Engineering“ in der muskuloskelettalen Medizin zur bestmöglichen biologischen Heilung geführt wird.

Facharzt für Orthopädie und Unfallchirurgie
Quellen:
- Bennell KL, Paterson KL, Metcalf BR, Duong V, Eyles J, Kasza J, Wang Y, Cicuttini F, Buchbinder R, Forbes A, Harris A, Yu SP, Connell D, Linklater J, Wang BH, Oo WM, Hunter DJ. Effect of Intra-articular Platelet-Rich Plasma vs Placebo Injection on Pain and Medial Tibial Cartilage Volume in Patients With Knee Osteoarthritis: The RESTORE Randomized Clinical Trial. 2021 Nov 23;326(20):2021-2030. doi: 10.1001/jama.2021.19415. PMID: 34812863; PMCID: PMC8611484.
- Nie LY, Zhao K, Ruan J, et al. Effectiveness of Platelet-Rich Plasma in the Treatment of Knee Osteoarthritis: A Meta-analysis of Randomized Controlled Clinical Trials. Orthopaedic journal of sports medicine 2021;9(3):2325967120973284
- Laudy A, Bakker E, Rekers M, et al. Efficacy of platelet-rich plasma injections in osteoarthritis of the knee: a systematic review and meta-analysis. Br J Sports Med 2015;49(10):657-72.
- Hohmann E, Tetsworth K, Glatt V. Is platelet-rich plasma effective for the treatment of knee osteoarthritis? A systematic review and meta-analysis of level 1 and 2 randomized controlled trials. European journal of orthopaedic surgery & traumatology : orthopedie traumatologie 2020;30(6):955-67.
- Dai WL, Zhou AG, Zhang H, et al. Efficacy of Platelet-Rich Plasma in the Treatment of Knee Osteoarthritis: A Meta-analysis of Randomized Controlled Trials. Arthroscopy 2017;33(3):659-70.
- Hong M, Cheng C, Sun X, et al. Efficacy and Safety of Intra-Articular Platelet-Rich Plasma in Osteoarthritis Knee: A Systematic Review and Meta-Analysis. BioMed research international 2021;2021:2191926.)
- Klatte-Schulz F, Schmidt T, Uckert M, Scheffler S, Kalus U, Rojewski M, Schrezenmeier H, Pruss A, Wildemann B. Comparative Analysis of Different Platelet Lysates and Platelet Rich Preparations to Stimulate Tendon Cell Biology: An In Vitro Study. Int J Mol Sci. 2018 Jan 10;19(1):212. doi: 10.3390/ijms19010212. PMID: 29320421; PMCID: PMC5796161.
- Marx, Robert E. DDS. Platelet-Rich Plasma (PRP): What Is PRP and What Is Not PRP? Implant Dentistry 10(4):p 225-228, December 2001.
- Chu J, Duan W, Yu Z, Tao T, Xu J, Ma Q, Zhao L, Guo JJ. Intra-articular injections of platelet-rich plasma decrease pain and improve functional outcomes than sham saline in patients with knee osteoarthritis. Knee Surg Sports Traumatol Arthrosc. 2022 Dec;30(12):4063-4071. doi: 10.1007/s00167-022-06887-7. Epub 2022 Feb 6. PMID: 35124707.
- Bansal H, Leon J, Pont JL, Wilson DA, Bansal A, Agarwal D, Preoteasa I. Platelet-rich plasma (PRP) in osteoarthritis (OA) knee: Correct dose critical for long term clinical efficacy. Sci Rep. 2021 Feb 17;11(1):3971. doi: 10.1038/s41598-021-83025-2. Erratum in: Sci Rep. 2021 Sep 14;11(1):18612. doi: 10.1038/s41598-021-98365-2. PMID: 33597586; PMCID: PMC7889864
- Sconfienza LM, Adriaensen M, Albano D, Alcala-Galiano A, Allen G, Aparisi Gómez MP, Aringhieri G, Bazzocchi A, Beggs I, Chianca V, Corazza A, Dalili D, De Dea M, Del Cura JL, Di Pietto F, Drakonaki E, Facal de Castro F, Filippiadis D, Gitto S, Grainger AJ, Greenwood S, Gupta H, Isaac A, Ivanoski S, Khanna M, Klauser A, Mansour R, Martin S, Mascarenhas V, Mauri G, McCarthy C, McKean D, McNally E, Melaki K, Mirón Mombiela R, Moutinho R, Obradov M, Olchowy C, Orlandi D, Prada González R, Prakash M, Posadzy M, Rutkauskas S, Snoj Ž, Stefano Tagliafico A, Talaska A, Tomas X, Vasilevska-Nikodinovska V, Vucetic J, Wilson D, Zaottini F, Zappia M, Messina C. Clinical indications for image-guided interventional procedures in the musculoskeletal system: a Delphi-based consensus paper from the European Society of Musculoskeletal Radiology (ESSR)-part V, knee. Eur Radiol. 2022 Mar;32(3):1438-1447. doi: 10.1007/s00330-021-08258-1. Epub 2021 Sep 14. PMID: 34523008; PMCID: PMC8831279.
- Kon, E., Di Matteo, B., Delgado, D., Cole, B. J., Dorotei, A., Dragoo, J. L., … Sánchez, M. (2020). Platelet-rich plasma for the treatment of knee osteoarthritis: an expert opinion and proposal for a novel classification and coding system. Expert Opinion on Biological Therapy, 20(12), 1447–1460. https://doi.org/10.1080/14712598.2020.1798925
- Patel S, Gahlaut S, Thami T, Chouhan DK, Jain A, Dhillon MS. Comparison of Conventional Dose Versus Superdose Platelet-Rich Plasma for Knee Osteoarthritis: A Prospective, Triple-Blind, Randomized Clinical Trial. Orthop J Sports Med. 2024 Feb 26;12(2):23259671241227863. doi: 10.1177/23259671241227863. PMID: 38410168; PMCID: PMC10896053.
- Zhuang W, Li T, Li Y, Zhang Y, Gao J, Wang X, Ding Q, Li W. The varying clinical effectiveness of single, three and five intraarticular injections of platelet-rich plasma in knee osteoarthritis. J Orthop Surg Res. 2024 May 8;19(1):284. doi: 10.1186/s13018-024-04736-6. PMID: 38720362; PMCID: PMC11077828.
- https://register.awmf.org/de/leitlinien/detail/187-050
- McAlindon TE, LaValley MP, Harvey WF, Price LL, Driban JB, Zhang M, Ward RJ. Effect of Intra-articular Triamcinolone vs Saline on Knee Cartilage Volume and Pain in Patients with Knee Osteoarthritis: A Randomized Clinical Trial. JAMA. 2017 May 16;317(19):1967-1975. doi: 10.1001/jama.2017.5283. PMID: 28510679; PMCID: PMC5815012
- Wijn SRW, Rovers MM, van Tienen TG, Hannink G. Intra-articular corticosteroid injections increase the risk of requiring knee arthroplasty. Bone Joint J. 2020 May;102-B(5):586-592. doi: 10.1302/0301-620X.102B5.BJJ-2019-1376.R1. PMID: 32349592
- Baums MH, Aquilina J, Pérez-Prieto D, Sleiman O, Geropoulos G, Totlis T. Risk analysis of periprosthetic knee joint infection (PJI) in total knee arthroplasty after preoperative corticosteroid injection: a systematic review : A study performed by the Early-Osteoarthritis group of ESSKA-European Knee Associates section. Arch Orthop Trauma Surg. 2023 May;143(5):2683-2691. doi: 10.1007/s00402-022-04532-z. Epub 2022 Jul 12. PMID: 35829737
- Grassi A, Napoli F, Romandini I, Samuelsson K, Zaffagnini S, Candrian C, Filardo G. Is Platelet-Rich Plasma (PRP) Effective in the Treatment of Acute Muscle Injuries? A Systematic Review and Meta-Analysis. Sports Med. 2018 Apr;48(4):971-989. doi: 10.1007/s40279-018-0860-1. PMID: 29363053
- Sheth U, Dwyer T, Smith I, Wasserstein D, Theodoropoulos J, Takhar S, Chahal J. Does Platelet-Rich Plasma Lead to Earlier Return to Sport When Compared With Conservative Treatment in Acute Muscle Injuries? A Systematic Review and Meta-analysis. Arthroscopy. 2018 Jan;34(1):281-288.e1. doi: 10.1016/j.arthro.2017.06.039. Epub 2017 Aug 8. PMID: 28800920
- Vale D, Pereira A, Andrade JP, Castro JP. The Role of Platelet-Rich Plasma Injection for Muscle Strains in Athletes. Cureus. 2024 May 19;16(5):e60585. doi: 10.7759/cureus.60585. PMID: 38894806; PMCID: PMC11184543
- Kruse RC, Eisenmann J, Glass NA, Petrachaianan K, Wilz L. Platelet-Poor vs Platelet-Rich Plasma For The Treatment Of Acute Thigh Muscle Injuries. Am J Phys Med Rehabil. 2024 Jul 3. doi: 10.1097/PHM.0000000000002591. Epub ahead of print. PMID: 38958567
- Miroshnychenko O, Chang WT, Dragoo JL. The Use of Platelet-Rich and Platelet-Poor Plasma to Enhance Differentiation of Skeletal Myoblasts: Implications for the Use of Autologous Blood Products for Muscle Regeneration. Am J Sports Med. 2017 Mar;45(4):945-953. doi: 10.1177/0363546516677547. Epub 2016 Dec 27. PMID: 28027451.x
- Raum G, Kenyon C, Bowers R. Platelet-Poor versus Platelet-Rich Plasma for the Treatment of Muscle Injuries. Curr Sports Med Rep. 2024 Jun 1;23(6):222-228. doi: 10.1249/JSR.0000000000001173. PMID: 38838685
- Jorda A, Campos-Campos J, Aldasoro C, Colmena C, Aldasoro M, Alvarez K, Valles SL. Protective action of ultrasound-guided electrolysis technique on the muscle damage induced by notexin in rats. PLoS One. 2022 Nov 28;17(11):e0276634. doi: 10.1371/journal.pone.0276634. PMID: 36441673; PMCID: PMC9704622
- Abat F, Valles SL, Gelber PE, Polidori F, Jorda A, García-Herreros S, Monllau JC, Sanchez-Ibáñez JM. An experimental study of muscular injury repair in a mouse model of notexin-induced lesion with EPI® technique. BMC Sports Sci Med Rehabil. 2015 Apr 17;7:7. doi: 10.1186/s13102-015-0002-0. PMID: 25897404; PMCID: PMC4403980
- Fitzpatrick J, Bulsara M, Zheng MH. The Effectiveness of Platelet-Rich Plasma in the Treatment of Tendinopathy: A Meta-analysis of Randomized Controlled Clinical Trials. Am J Sports Med. 2017 Jan;45(1):226-233. doi: 10.1177/0363546516643716. Epub 2016 Jul 21. PMID: 27268111
- Filardo G, Di Matteo B, Kon E, Merli G, Marcacci M. Platelet-rich plasma in tendon-related disorders: results and indications. Knee Surg Sports Traumatol Arthrosc. 2018 Jul;26(7):1984-1999. doi: 10.1007/s00167-016-4261-4. Epub 2016 Sep 24. PMID: 27665095
- Lu J, Li H, Zhang Z, Xu R, Wang J, Jin H. Platelet-rich plasma in the pathologic processes of tendinopathy: a review of basic science studies. Front Bioeng Biotechnol. 2023 Jul 21;11:1187974. doi: 10.3389/fbioe.2023.1187974. PMID: 37545895; PMCID: PMC10401606
- Halpern BC, Chaudhury S, Rodeo SA. The role of platelet-rich plasma in inducing musculoskeletal tissue healing. HSS J. 2012 Jul;8(2):137-45. doi: 10.1007/s11420-011-9239-7. Epub 2012 Jan 18. PMID: 23874254; PMCID: PMC3715623
- Chalidis B, Givissis P, Papadopoulos P, Pitsilos C. Molecular and Biologic Effects of Platelet-Rich Plasma (PRP) in Ligament and Tendon Healing and Regeneration: A Systematic Review. Int J Mol Sci. 2023 Feb 1;24(3):2744. doi: 10.3390/ijms24032744. PMID: 36769065; PMCID: PMC9917492
- Alsousou J, Thompson M, Harrison P, Willett K, Franklin S. Effect of platelet-rich plasma on healing tissues in acute ruptured Achilles tendon: a human immunohistochemistry study. 2015 Feb 26;385 Suppl 1:S19. doi: 10.1016/S0140-6736(15)60334-8. PMID: 26312841
- Desouza C, Shetty V. Effectiveness of platelet-rich plasma in partial-thickness rotator cuff tears: a systematic review. J ISAKOS. 2024 Apr 18:S2059-7754(24)00080-4. doi: 10.1016/j.jisako.2024.04.010. Epub ahead of print. PMID: 38641254
- Dakkak M, Saleem A, Patel D, Yeager M, Oliveira L, Gilot G, Spindler KP. A systematic review of randomized control trials looking at functional improvement of rotator cuff partial thickness tears following platelet-rich-plasma injection: a comparison of glenohumeral joint vs. subacromial bursa vs. intratendinous injection locations. JSES Int. 2024 Jan 24;8(3):464-471. doi: 10.1016/j.jseint.2024.01.003. PMID: 38707549; PMCID: PMC11064684
- Puzzitiello RN, Patel BH, Forlenza EM, Nwachukwu BU, Allen AA, Forsythe B, Salzler MJ. Adverse Impact of Corticosteroids on Rotator Cuff Tendon Health and Repair: A Systematic Review of Basic Science Studies. Arthrosc Sports Med Rehabil. 2020 Apr 8;2(2):e161-e169. doi: 10.1016/j.asmr.2020.01.002. PMID: 32368753; PMCID: PMC7190543
- Xu Y, Li T, Wang L, Yao L, Li J, Tang X. Platelet-Rich Plasma Has Better Results for Long-term Functional Improvement and Pain Relief for Lateral Epicondylitis: A Systematic Review and Meta-analysis of Randomized Controlled Trials. Am J Sports Med. 2024 Feb 15:3635465231213087. doi: 10.1177/03635465231213087. Epub ahead of print. PMID: 38357713
- Li S, Yang G, Zhang H, Li X, Lu Y. A systematic review on the efficacy of different types of platelet-rich plasma in the management of lateral epicondylitis. J Shoulder Elbow Surg. 2022 Jul;31(7):1533-1544. doi: 10.1016/j.jse.2022.02.017. Epub 2022 Mar 23. PMID: 35337955
- Llombart R, Mariscal G, Barrios C, Llombart-Ais R. The Best Current Research on Patellar Tendinopathy: A Review of Published Meta-Analyses. Sports (Basel). 2024 Feb 1;12(2):46. doi: 10.3390/sports12020046. PMID: 38393266; PMCID: PMC10893258
- Dupley L, Charalambous CP. Platelet-Rich Plasma Injections as a Treatment for Refractory Patellar Tendinosis: A Meta-Analysis of Randomised Trials. Knee Surg Relat Res. 2017 Sep 1;29(3):165-171. doi: 10.5792/ksrr.16.055. PMID: 28854761; PMCID: PMC5596405
- Barman A, Sinha MK, Sahoo J, Jena D, Patel V, Patel S, Bhattacharjee S, Baral D. Platelet-rich plasma injection in the treatment of patellar tendinopathy: a systematic review and meta-analysis. Knee Surg Relat Res. 2022 May 4;34(1):22. doi: 10.1186/s43019-022-00151-5. PMID: 35509070; PMCID: PMC9066802
- Bosco F, Giai Via R, Giustra F, Ghirri A, Cacciola G, Massè A. Platelet-rich plasma for jumper’s knee: a comprehensive review of efficacy, protocols, and future directions. Eur J Orthop Surg Traumatol. 2024 Jan;34(1):91-96. doi: 10.1007/s00590-023-03713-9. Epub 2023 Sep 5. PMID: 37668753; PMCID: PMC10771364
- Arthur Vithran DT, Xie W, Opoku M, Essien AE, He M, Li Y. The Efficacy of Platelet-Rich Plasma Injection Therapy in the Treatment of Patients with Achilles Tendinopathy: A Systematic Review and Meta-Analysis. J Clin Med. 2023 Jan 28;12(3):995. doi: 10.3390/jcm12030995. PMID: 36769643; PMCID: PMC9918262
- Atilano L, Martin N, Ignacio Martin J, Iglesias G, Mendiola J, Bully P, Aiyegbusi A, Manuel Rodriguez-Palomo J, Andia I. Ultrasound-Guided Subfascial Platelet-Rich Plasma Injections Versus Enthesis Needling for Greater Trochanteric Pain Syndrome: A Randomized Controlled Trial. Orthop J Sports Med. 2024 May 14;12(5):23259671241249123. doi: 10.1177/23259671241249123. PMID: 38751852; PMCID: PMC11095191
- Fitzpatrick J, Bulsara MK, O’Donnell J, Zheng MH. Leucocyte-Rich Platelet-Rich Plasma Treatment of Gluteus Medius and Minimus Tendinopathy: A Double-Blind Randomized Controlled Trial With 2-Year Follow-up. Am J Sports Med. 2019 Apr;47(5):1130-1137. doi: 10.1177/0363546519826969. Epub 2019 Mar 6. PMID: 30840831
- Sibbitt WL Jr, Peisajovich A, Michael AA, Park KS, Sibbitt RR, Band PA, Bankhurst AD. Does sonographic needle guidance affect the clinical outcome of intraarticular injections? J Rheumatol. 2009 Sep;36(9):1892-902. doi: 10.3899/jrheum.090013. Epub 2009 Jul 31. PMID: 19648304
- Huang Z, Du S, Qi Y, Chen G, Yan W. Effectiveness of Ultrasound Guidance on Intraarticular and Periarticular Joint Injections: Systematic Review and Meta-analysis of Randomized Trials. Am J Phys Med Rehabil. 2015 Oct;94(10):775-83. doi: 10.1097/PHM.0000000000000260. PMID: 25768070