Eine gelungene perioperative Schmerztherapie verbessert Patientensicherheit und Erholung durch individuelle, strukturierte Maßnahmen. Sie basiert auf kontinuierlicher Schmerzerfassung, einer konstanten Basisschmerztherapie und bedarfsorientierter Analgesie. Multimodale Ansätze wie Regionalanästhesie und patientenkontrollierte Analgesie erhöhen die Effektivität und reduzieren Opioide. Wichtig sind zudem Nebenwirkungsmanagement und die Berücksichtigung von Organfunktionen und Arzneimittelinteraktionen.
Schmerzmechanismen
Eine chirurgische Inzision hat eine Freisetzung lokaler sensibler Gewebe-Nozizeptoren zur Folge, die wiederum eine Neuroinflammation und Neuroimmunreaktion in den Dorsalganglien bewirken. Dieser, einer Entzündungsreaktion ähnelnder, Prozess verdeutlicht die gute Wirksamkeit von NSAR bei postoperativen, klassisch nozizeptiven Schmerzen.1 Selten treten postoperativ auch neuropathische Schmerzen auf, wenn Nerven direkt geschädigt werden. Unter anderem kommt es zur überschießenden Natrium-Kanal-Expression an peripheren Nozizeptoren, die zur sogenannten Plus- und Minussymptomatik führen. Diese können sich durch einschießend, brennende, kribbelnde Schmerzqualität, sowie Sensibilitätsverminderung oder extreme Berührungsempfindlichkeit (Allodynie) äußern. Neuropathische Schmerzen sprechen typischerweise eher schlecht auf Opioide an. In diesen speziellen Fällen stößt man mit klassischen postoperativen Schmerztherapie-Konzepten an seine Grenzen.2,3
Fazit
Neuropathische Schmerzen postoperativ verlangen gezielte Diagnostik und Therapie.
Basis der Schmerztherapie
Die Basis der Schmerztherapie beginnt bereits präoperativ mit einer gezielten Anamnese, um Risikofaktoren für starke postoperative Schmerzen wie Opioidgebrauch oder psychosomatische Erkrankungen zu erkennen. Auch das frühzeitige Erfassen eines Delirrisikos ist wichtig für das Narkosemanagement und die Prophylaxe. Nicht-medikamentöse Maßnahmen wie Entspannung und Ablenkung können vom Pflegepersonal unterstützt werden, ebenso sollten psychologische Aspekte beachtet werden. Physiotherapie und physikalische Methoden wie Frühmobilisation, Bewegungsübungen, Thermotherapie und TENS sind zentral für die postoperative Schmerzbehandlung. Während der Operation wird, wenn möglich, lokale Infiltrationsanästhesie (LIA) eingesetzt.3
Fazit
Prävention ist der Schlüssel – Schmerztherapie beginnt vor dem Schnitt.
Schmerzeingrenzung
Die Schmerzanamnese ist Grundlage jeder Therapie, da Schmerz subjektiv und nicht immer proportional zum Eingriff ist. Zur Bewertung der Schmerzintensität werden meist die Visuelle Analogskala (VAS) oder Numerische Ratingskala (NRS) genutzt, wobei Werte über 3/10 behandlungsbedürftig sind. Erfasst werden Schmerzbeginn, -dauer, -lokalisation, -qualität, Auslöser, psychische Faktoren sowie Therapieerwartungen und -erfahrungen. Bei Kindern, älteren oder kognitiv eingeschränkten Patienten sind nonverbale Zeichen und psychosoziale Faktoren besonders wichtig.
Die Wirksamkeit von Bedarfsanalgetika wird 30 Minuten nach i.v. und 60 Minuten nach oraler Gabe kontrolliert. Schmerzerfassung sollte alle 2 Stunden in den ersten 24 Stunden nach großen Eingriffen sowie bei Schmerzveränderungen und nach Interventionen erfolgen, bei bestehender Analgesie mindestens alle 8 Stunden.
Zuständigkeiten
Das perioperative Schmerzmanagement braucht klare hausinterne Regelungen und einen strukturierten Akutschmerzdienst, um Patientenzufriedenheit zu steigern. Schriftlich festgelegte, prozedurenspezifische Therapiealgorithmen sorgen für standardisierte Behandlung und Handlungssicherheit. Pflegekräfte können innerhalb definierter Grenzen eigenverantwortlich Bedarfsmedikation verabreichen.4
Die postoperative Verantwortung liegt meist bei der operierenden Abteilung – bei Katheterverfahren bei der Anästhesie – was enge interdisziplinäre Zusammenarbeit erfordert. Regelmäßige Dokumentation unterstützt die Therapieanpassung. Im Entlassbrief sollte die temporäre Opioidindikation und das Ausschleichen klar vermerkt sein.
Fazit
Verantwortung regeln – Teamwork leben – Schmerz besser managen.
Medikamentöse Basisanalgesie im perioperativen Schmerzmanagement
Die effektivste postoperative Analgesie beruht auf einer Kombination von zwei oder mehreren Analgetika mit unterschiedlichen pharmakologischen Wirkmechanismen. Dabei zeigen sich insbesondere die Kombination aus einem Nichtopioidanalgetikum, einem Regionalanästhesieverfahren und/oder einem Opioid als evidenzbasiert wirksam. Die Verordnung dieser Substanzen sollte stets zeitlich begrenzt erfolgen.
Insbesondere im orthopädisch-unfallchirurgischen Setting müssen neben der reinen Schmerzlinderung auch funktionelle Ziele wie die frühzeitige Mobilisation sowie die Vermeidung postoperativer Komplikationen unterstützt werden. Zusätzlich stehen entzündungshemmende und knochenbiologische Effekte im Fokus der analgetischen Strategie.
Nichtopioidanalgetika (NOPA)
Nichtsteroidale Antirheumatika (NSAR) bleiben aufgrund ihrer antiphlogistischen sowie ossifikationshemmenden Wirkung ein unverzichtbarer Bestandteil bei elektiven orthopädischen Eingriffen. Paracetamol und Metamizol kommen additiv zur Anwendung, wobei Metamizol dem Paracetamol in der analgetischen Wirksamkeit überlegen ist.
Metamizol wirkt stark analgetisch und antipyretisch mit geringer Nebenwirkungsrate. Schnelle i.v.-Gabe (> 500 mg/min) kann arterielle Hypotonie verursachen. Anwendung bei Niereninsuffizienz möglich. Risiko einer Agranulozytose und typische Symptome (Fieber, Schleimhautentzündung, Dysphagie) müssen aufgeklärt werden, da sie unter Antibiotika maskiert sein können.
Paracetamol bietet eine analgetische und antipyretische Wirkung, jedoch ohne antiphlogistischen Effekt. Es weist eine gute Verträglichkeit auf, verursacht keine gastrointestinalen Nebenwirkungen oder Blutungsneigung und besitzt opiat-sparende Eigenschaften. Eine Überdosierung birgt jedoch das Risiko einer Hepatotoxizität.
Klassische NSAR (z. B. Ibuprofen, Diclofenac) bergen Nebenwirkungen wie gastrointestinale Ulzera, renale und kardiovaskuläre Risiken sowie eine erhöhte Blutungsneigung. Insbesondere bei vorbestehender Herzinsuffizienz (NYHA II–IV), koronarer Herzkrankheit, pAVK oder zerebrovaskulären Erkrankungen sind NSAR kontraindiziert.
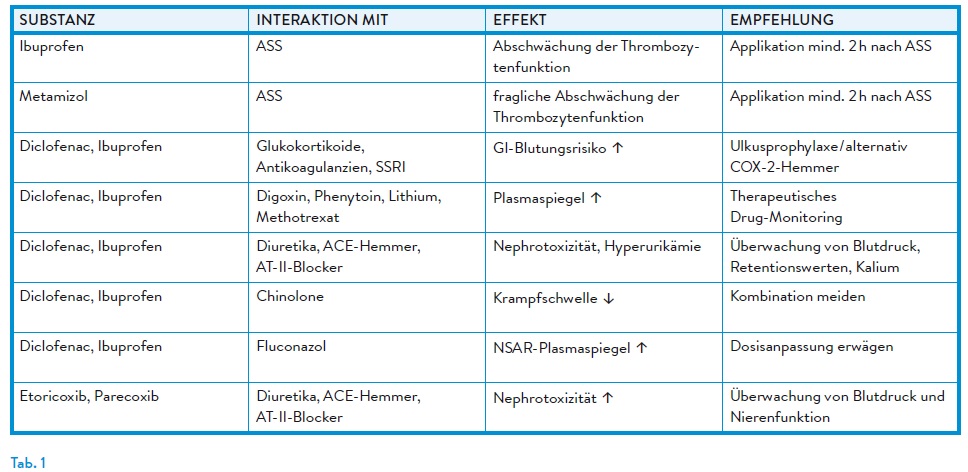
COX-2-Inhibitoren zeichnen sich durch eine bessere gastrointestinale Verträglichkeit aus, sind jedoch bei Langzeittherapie mit einem erhöhten kardiovaskulären Risiko assoziiert. Parecoxib hat als Vertreter der COX-2-Hemmer keinen Einfluss auf die Thrombozytenaggregation und scheint das Risiko für Blutungen nicht zu erhöhen. Kontraindikationen umfassen u. a. Analgetikaasthma, kardiovaskuläre Erkrankungen sowie Niereninsuffizienz. Ibuprofen, Diclofenac und Parecoxib stehen auch zur i.v.-Gabe unmittelbar perioperativ zur Verfügung. (Tab. 1)
Klinisch relevante Arzneimittelinteraktionen
Insbesondere klassische NSAR wie Ibuprofen konkurrieren mit ASS um die Bindungsstelle an der Cyclooxygenase-1 (COX-1). Durch die reversible Besetzung des aktiven Zentrums verhindern NSAR den irreversiblen Zugang von ASS zum Enzym. Dies kann die gewünschte thrombozytenaggregationshemmende Wirkung von ASS abschwächen oder sogar aufheben.1
Opioidanalgetika
Opioide wirken über μ-Opioidrezeptoren, die als G-Protein-gekoppelte Rezeptoren auf peripherer, spinaler und supraspinaler Ebene die Schmerzweiterleitung hemmen. Sie behalten insbesondere bei akuten postoperativen Schmerzen ihre klinische Relevanz, sind jedoch mit möglichen Nebenwirkungen wie Sedierung, Übelkeit, Juckreiz, Atemdepression oder Delir verbunden. Durch Kombination mit Nichtopioidanalgetika und koanalgetischen Verfahren kann die benötigte Opioiddosis deutlich reduziert werden.
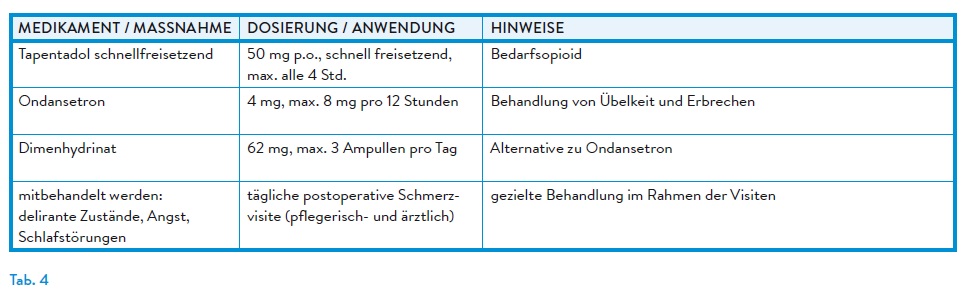
In der klinischen Praxis werden retardierte und unretardierte Opioide individuell an Alter, Organfunktion und Operationstyp angepasst. Retardpräparate dienen der Basisanalgesie, niedrig dosiert. Nicht-retardierte Präparate ermöglichen die bedarfsadaptierte Dosistitration.
Retardierte niederpotente Opioide, wie Tramadol oder Tilidin/Naloxon, werden trotz ihrer Relevanz in WHO-Stufe II in der unmittelbaren postoperativen Analgesie zunehmend seltener eingesetzt. Gründe sind unter anderem das ausgeprägte Nebenwirkungsprofil und eine schlechte Steuerbarkeit aufgrund individueller Metabolisierungsunterschiede. Sie können jedoch im Entlassmanagement zur kontrollierten Reduktion der Opioidgabe sinnvoll eingesetzt werden.
Vertreter retardierter hochpotenter Basisopioide:
→ Tapentadol: dualer Wirkmechanismus als μ-Opioidrezeptor-Agonist und Noradrenalinwiederaufnahmehemmer, geringe Affinität zum μ-Opioidrezeptor → weniger Nebenwirkungen, Vorsicht bei schwerer Niereninsuffizienz.7
→ Oxycodon: geringere Affinität als Morphin zum μ-Opioidrezeptor, Dosisreduktion bei GFR < 30 ml/min, Kontraindikation bei schwerer Leberinsuffizienz, erhöhtes Abhängigkeitspotenzial.5
Vertreter nicht-retardierter Bedarfsopioide:
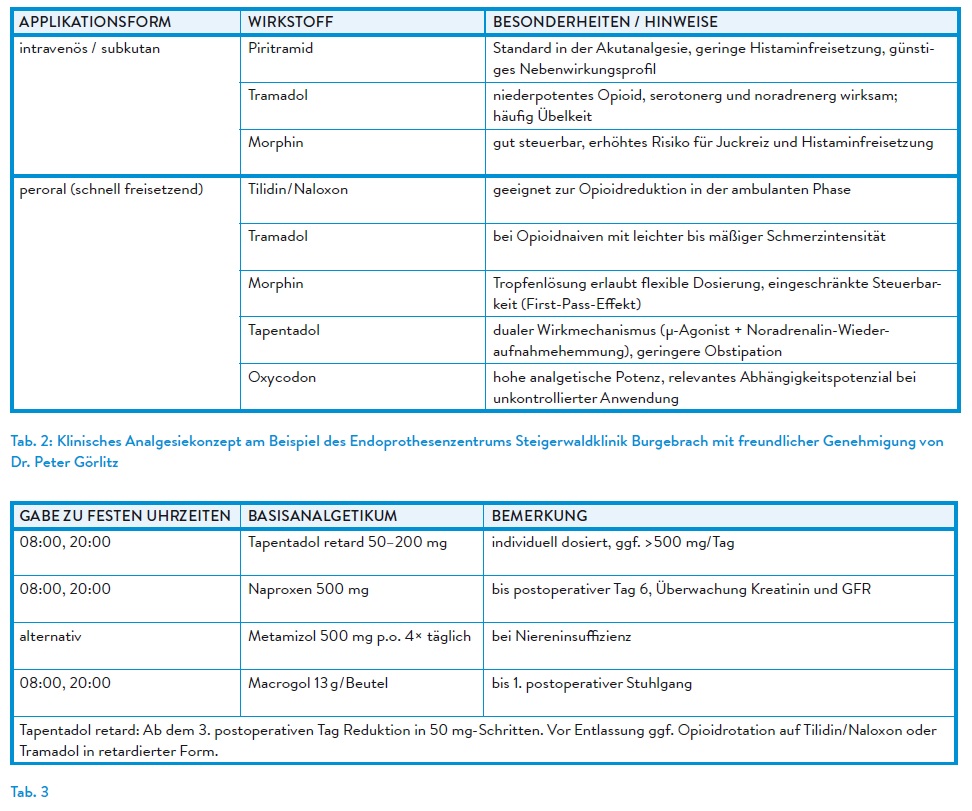
Nicht-retardierte Opioidanalgetika kommen in der postoperativen Schmerztherapie insbesondere zur Dosistitration in der Frühphase nach Eingriffen zum Einsatz. Galenik, Wirkstärke, Metabolisierung und Nebenwirkungsprofil sollten patientenindividuell berücksichtigt werden, idealerweise am gleichen Wirkstoff wie das Basisopioid orientiert. (Tab. 2)
Fazit
Analgetika gezielt kombinieren – Wirkung steigern, Risiken begrenzen.
Patientenkontrollierte Analgesie (PCA)
Die selbstgesteuerte Bolusapplikation von Opioiden über eine programmierbare Schmerzpumpe verbessert die Schmerzkontrolle und Patientenzufriedenheit bei reduzierten Nebenwirkungen. Standardmäßig erfolgt eine kontinuierliche Basisinfusion mit individuell einstellbaren Sperrintervallen. Änderungen an der PCA-Pumpe dürfen nur durch ärztliches oder geschultes Fachpersonal erfolgen. Risiken bestehen insbesondere bei Patienten mit Hypoventilation, Schlafapnoe oder erhöhter Opioidsensitivität. Hier ist eine kontinuierliche Pulsoxymetrie mit telemetrischer Überwachung empfehlenswert. (Tab. 5)6
Wenn der Schmerzstandard an seine Grenzen stößt
Bei Ausschöpfen der standardisierten Basis- und Bedarfsanalgesie oder bei in der Anamnese bereits bestehenden Hinweisen auf vermehrte postoperative Schmerzen können Koanalgetika bzw. sogenannte Adjuvantien erwogen werden.3
Balanciertes Schmerztherapiekonzept
Rückenmarksnahe und periphere Regionalanästhesieverfahren sind der systemischen Opioidtherapie gleichwertig und ermöglichen opioidreduzierte Analgesiekonzepte. Ultraschallgestützte Techniken haben den Einsatz peripherer Blockaden erweitert. Standardlokalanästhetika wie Ropivacain oder Bupivacain werden durch volumenreduzierte Applikationstechniken ergänzt, um motorische Funktionen zu schonen und die Mobilisation zu fördern.8
Ein typisches Beispiel ist die Knieendoprothetik: Während die Femoraliskatheteranlage eine gute Analgesie bietet, limitiert sie durch motorische Blockade die Mobilität. Selektive Blockaden im Adduktorenkanal (N. saphenus, N. obturatorius) bieten eine geeignete Alternative mit geringerer Einschränkung. Plexuskatheter der oberen Extremität (z. B. interskalenär, supraklavikulär) ermöglichen effektive Analgesie ohne Mobilitätsverlust. Entscheidend ist eine tägliche Reevaluation der Blockadeausprägung und individuell angepasste Applikationsrate.
Die epidurale Analgesie besitzt weiterhin hohes analgetisches Potenzial, geht jedoch mit erheblichem logistischem Aufwand, Mobilitätseinschränkung und Risiken wie Harnverhalt oder Hämatombildung einher. Ihr Einsatz erfolgt daher heute in der Orthopädie nur noch bei klarer Indikation.1,3
Fazit
Wo Standardanalgesie nicht ausreicht, braucht es adjuvante Strategien und regionalanästhesiologische Präzision.